Кількісне визначення ліпопротеїнів, багатих на тригліцериди у здорових чоловіків, шляхом маркування ефіру ретинілу та одночасного вимірювання аполіпопротеїнів B-48 та B-100
Від дослідницького відділу атеросклерозу, Науково-дослідний інститут короля Густава V, Медичний факультет, лікарня Каролінська, Інститут Каролінської, Стокгольм, Швеція.
Від дослідницького відділу атеросклерозу, Науково-дослідний інститут короля Густава V, Медичний факультет, лікарня Каролінська, Інститут Каролінської, Стокгольм, Швеція.
Від дослідницького відділу атеросклерозу, Науково-дослідний інститут короля Густава V, Медичний факультет, лікарня Каролінська, Інститут Каролінської, Стокгольм, Швеція.
Від дослідницького відділу атеросклерозу, Науково-дослідний інститут короля Густава V, Медичний факультет, лікарня Каролінська, Інститут Каролінської, Стокгольм, Швеція.
Анотація
Тригліцериди містяться в ліпопротеїнах плазми, щоб забезпечити енергією периферичні тканини. По суті, ліпопротеїн-ліпаза (LPL) гідролізує тригліцериди ядра до вільних жирних кислот або для негайного використання в м’язах, або для зберігання в жировій тканині. Однак іншою стороною медалі може бути накопичення потенційно атерогенних залишкових частинок ліпопротеїдів. 1 Ліпопротеїн дуже низької щільності (ЛНПНЩ), синтезований в печінці людини, має апоВ-100 як основний білковий компонент, на відміну від хіломікронів, що виділяються з кишечника після прийому жиру, у яких апоВ-48 є структурним білком. Два апо-вмісні види ліпопротеїнів поділяють і конкурують за один і той же ліполітичний шлях2, але кишкові тригліцериди, здається, є улюбленим субстратом для ЛПЛ. ApoB-48 у хіломікронах та їх залишках виявляється при дуже низькій концентрації в плазмі як натще, так і після їжі, тоді як VLDL apoB-100 значно зростає після прийому жиру, імовірно через затримку гідролізу. Насправді велика частка ліпопротеїнемії, виявленої після вживання жиру, припадає на ЛПНЩ. 3 4 Однак нещодавно було продемонстровано, що збільшення рівня тригліцеридів ЛПНЩЩ становить лише приблизно 20% тригліцеридів після їжі. 5
Попадання вітаміну А з жиром призводить до мічення ретинілового ефіру хіломікронів. 6 Таким чином, доповнення випробовуваної їжі вітаміном А зазвичай використовується як засіб кількісного визначення ліпопротеїдів кишкового походження в постпрандиальном стані. 7 8 9 10 11 12 13 14 15 16 17 Однак, точність використання вітаміну А в цьому контексті піддається сумніву. 18 Ретинілпальмітат (RP) з’являвся у, мабуть, ендогенних ліпопротеїнах у пізні моменти часу, і пік RP затримувався порівняно з тригліцеридами плазми та піками apoB-48, що спостерігалися після споживання жиру. 18
Методи
Предмети
Здорові чоловіки віком від 35 до 45 років були набрані в рамках опитування населення, що включало 160 суб'єктів північноєвропейського походження. Загалом 129 із 160 чоловіків, з якими звернулися, погодились здати зразки крові для рутинного визначення ліпопротеїнів плазми натще. Щоб дозволити ідентифікувати однорідну групу суб'єктів нормоліпідемії, було проведено фенотипування апоЕ 19, а для фенотипування ліпопротеїнів використовували 90-й процентиль плазмових концентрацій тригліцеридів ЛПНЩ і ліпопротеїдів низької щільності (ЛПНЩ). Після того, як були відібрані суб'єкти, гомозиготні за алелем ε3 з нормальним вмістом тригліцеридів VLDL плазми натще та холестерину LDL (нижче 1,95 та 4,70 ммоль/л, відповідно), залишилось 58 суб'єктів. З них 38 випадково були обрані для цього дослідження та попрошені прийти на пероральний тест на толерантність до жиру. З 38 дев'ять відмовились від участі, а двоє зрештою не змогли взяти участь, що залишило 27 суб'єктів для цього звіту.
Оральне жирове навантаження
Забір крові
Зразки венозної крові відбирали у попередньо охолоджені стерильні пробірки (Vacutainer, Becton Dickinson), що містять Na2EDTA (кінцева концентрація, 4 ммоль/л), які миттєво поміщали у крижану воду та захищали від світла. Потім плазму відновлювали протягом 30 хвилин низькошвидкісним центрифугуванням (1.750g, 20 хвилин, 1 ° C) і витримують при цій температурі протягом усіх процедур підготовки. Фенілметилсульфонілфторид (10 ммоль/л, розчинений у ізопропанолі) та апротинін (1400 мкг/мл) (Трасилол, Байєр) негайно додавали до ізольованої плазми перед фракціонуванням багатих тригліцеридами ліпопротеїдів до кінцевих концентрацій 10 мкмоль/л та 28 мкг/мл відповідно.
Фракціонування ліпопротеїнів
Визначення ApoB-48 та ApoB-100
Визначення RP
Плазма та фракції багатих тригліцеридами ліпопротеїдів були захищені від світла протягом усієї процедури приготування. Обсяги від 100 до 250 мкл плазми та багатих тригліцеридами фракцій ліпопротеїнів екстрагували 4 мл метанолу та 4 мл гексану. Верхню фазу видаляли, і розчинник випаровували слабким потоком N2. Ліпід розчиняли у 200 мкл метанол/хлороформ (3: 1) і вводили у високоефективну систему рідинної хроматографії (System Gold, Beckman). RP елюкували ізократично метанолом, і піки реєстрували за допомогою поглинання УФ при 326 нм. Піки інтегрували із програмним забезпеченням System Gold, і концентрацію визначали за стандартною кривою з п’яти розведень (7,6 - 38 нмоль) високоочищеного RP (Sigma R-3375). Середнє відновлення RP у фракціях порівняно з плазмою становило 89 ± 15% через 3 години та 86 ± 17% через 6 годин. При аналізі одного і того ж зразка у трьох примірниках коефіцієнти варіації становили 1,8% для плазми з високим (6-годинний зразок) та 5,8% для зразка плазми з низьким вмістом RP (9-годинний зразок).
Оборот ліпопротеїдів, мічених RP
Для вивчення обороту мічених RP вміщених тригліцеридів ліпопротеїдів була використана методика, розроблена Берром та Керном 24 25 з незначними модифікаціями. П'ятеро здорових чоловіків вживали змішаний прийом їжі з вітаміном А. Через 4 години проводили плазмаферез, щоб виділити приблизно 0,5 л постпрандіальної плазми, що містить мічені тригліцеридами багаті ліпопротеїди тригліцеридів. Плазмовий мішок зберігали при 4 ° C на піддоні, що повільно струшував, та вводили внутрішньовенно внутрішньовенно через 24 години після плазмаферезу. Випробовуваним було наказано їсти легкий сніданок о 7 ранку, а вливання відбулося о 11 до 11:30 того дня. Інфузію закінчували протягом 4 - 5 хвилин. Зразки крові відбирали до (три зразки протягом 7,5 хвилин) та 1, 2,5, 5, 7,5, 10, 15, 20, 30, 45, 60, 90, 120, 180, 240 та 360 хвилин після закінчення інфузії. Із зразків крові та плазмових мішків виділяли плазму, і визначали концентрацію RP у Sf> 400, Sf від 60 до 400 та Sf від 20 до 60 ліпопротеїнових фракцій, як описано раніше. У таблиці 1 перелічено характеристики п’яти суб’єктів, які проходять плазмаферез та реін’єкцію міченої РП постпрандіальної плазми.
Основні ліпопротеїни плазми
Основні ліпопротеїни плазми натощак (ЛПНЩ, ЛПНЩ та ліпопротеїни високої щільності [ЛПВЩ]) визначали комбінацією препаративного ультрацентрифугування та осадження апоВ-вмісних ліпопротеїдів з подальшим аналізом ліпідів. 26 Загальний рівень холестерину 27 та тригліцеридів 28 визначали у трьох примірниках у плазмі та у фракціях ліпопротеїдів. Спочатку ліпіди екстрагували хлороформом/метанолом. Потім визначали холестерин і тригліцериди на ультралабі (LKB).
Статистичний аналіз
Для розрахунку середніх значень та SD використовувались звичайні методи. SD подано в тексті; SEM наведено на рисунках. Коефіцієнти варіації взаємовипробувань та внутрішньоаналізів розраховували за стандартними процедурами. 30 Коефіцієнт варіації був заданий як SD у відсотках. Асоціації між параметрами ліпопротеїнів визначали шляхом обчислення коефіцієнтів рангової кореляції Спірмена.
Етичні міркування
Протокол дослідження був затверджений місцевим комітетом з етики в лікарні Каролінської. Усі випробувані дали інформовану згоду.
Результати
Основні характеристики
На момент навантаження ротової порожнини жиром загалом у 24 чоловіків рівень тригліцеридів ЛПНЩ та холестерину ЛПНЩ натощак був нижчим за 90-й процентиль від їх вікового сегменту населення. У трьох суб'єктів спостерігалася гіпертригліцеридемія легкого та середнього ступеня (тригліцериди ЛПНЩ 2,10, 2,81 та 4,95 ммоль/л, відповідно) та аналізувались окремо. Чотири з 24 нормотригліцеридемічних та 1 з 3 гіпертригліцеридемічних чоловіків були курцями. Індекс маси тіла був нижче 28,0 кг/м 2 у всіх суб'єктів (середнє значення ± SD, 24,1 ± 2,2 та 24,6 ± 2,7 кг/м 2 у нормотригліцеридемічних та гіпертригліцеридемічних пацієнтів відповідно). У таблиці 2 наведено концентрацію холестерину та тригліцеридів натще у плазмі натще у основних фракціях ліпопротеїдів. У суб'єктів гіпертригліцеридемії рівень холестерину ЛПНЩ був у тому ж діапазоні, що і у нормотригліцеридеміків (2,71-3,84 ммоль/л), тоді як рівень холестерину ЛПВЩ був нижчим (0,66-1,17 ммоль/л).
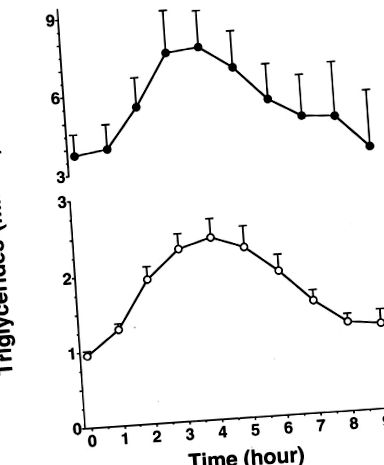
Тригліцериди плазми зросли з 0,99 ± 0,35 до 2,31 ± 1,11 ммоль/л через 4 години і повернулись до вихідних значень через 8 годин після прийому жиру в роті у пацієнтів із нормотригліцеридемією (рис. 1). Пікове значення для трьох гіпертригліцеридемічних пацієнтів було досягнуто через 4 години і повернуто до вихідного рівня протягом 9 годин (рис. 1).
Концентрації плазмової плазми ApoB-48 та ApoB-100
Існувала значна неоднорідність у відповідях на споживання жиру плазмових тригліцеридів, apoB-48 та apoB-100 у субфракціях багатих тригліцеридами ліпопротеїнів, незважаючи на те, що вивчались здорові нормоліпідемічні суб'єкти з фенотипом apo ε3/ε3. Медіана відносного збільшення тригліцеридів цілої плазми крові від 0 до 3 годин становила 117% (діапазон, від 20% до 316%); відповідний показник для Sf від 60 до 400 апоВ-100 становив 81% (діапазон, від -20 до 1912%). Цікаво, що відносне збільшення Sf від 60 до 400 апоВ-48 становило 79% (від 3% до 168%). Це вказує на те, що концентрація Sf від 60 до 400 апоВ-100 після їжі була найбільш гетерогенною змінною.
Індекс маси тіла не суттєво корелював зі збільшенням апоВ-100 у фракціях Sf від 20 до 60 та Sf від 60 до 400 між 0 та 3 годинами або відповідним збільшенням між 0 та 6 годинами (дані не наведені).
Взаємозв’язки концентрації ApoB-48 та ApoB-100 після голодування
Оборот ліппротеїнів, багатих тригліцеридами, що містять RP, після їжі
Обговорення
У цьому дослідженні було розглянуто метаболізм багатих тригліцеридами ліпрів білків у здорових чоловіків після прийому стандартизованого перорального жирового навантаження. У стані голодування були виявлені дуже низькі концентрації ліпопротеїнів, що містять апоВ-48, а збільшення кількості хіломікронів та їх залишків після споживання жиру було абсолютно незначним. На відміну від цього, спостерігалося значне збільшення великих ЛПНЩ (Sf від 60 до 400 апоВ-100), тоді як концентрація малого ЛПНЩ у плазмі крові (Sf від 20 до 60 апоВ-100) у плазмі не впливала на навантаження жирової тканини через рот. Раніше ми описували подібну реакцію на споживання жиру в дослідженні, що включало вибрані нормотригліцеридемічні та гіпертригліцеридемічні молоді пацієнти постінфарктного періоду серед чоловіків та невелику групу чоловіків, які контролювали нормоліпідемію. 4
Рівні апоВ-100 і особливо апоВ-48 у плазмі крові у різних фракціях ліпопротеїнів у плазмі були дещо нижчими у цьому дослідженні, ніж у попередньому дослідженні невеликої групи здорових чоловіків. 4 Це може мати кілька пояснень. По-перше, раніше описані суб'єкти контролю були приблизно на 10 років старшими. По-друге, у цьому дослідженні було використано вдосконалений метод кількісного визначення apoB-48 та apoB-100, який перевірявся на основі амінокислотного аналізу відповідних білків. 23 Попередній метод базувався на відносній хромогенності апоВ-48 та апоВ-100 у фракціях багатих тригліцеридами ліпопротеїдів на паличкових гелях SDS-PAGE. Ця остання процедура може мати властиві методологічні проблеми, якщо гелі перевантажені. 23
Рівень апоB-48 та apoB-100 у плазмі крові натощак та після їжі у фракціях ліпопротеїнів Sf> 400, Sf 60-400 та Sf 20-60 демонстрував значну неоднорідність, незважаючи на те, що здорові нормоліпідемічні суб'єкти, які не були здоровими, були гомозиготними за алелем ε3 були обрані. Післягодинна 3-годинна реакція великого рівня ЛПНЩ (Sf від 60 до 400 апоВ-100) на споживання жиру була надзвичайно мінливою - від невеликого зниження до 20-кратного збільшення. Це було на відміну від цілих плазмових тригліцеридів та залишків хіломікрону, збільшення яких становило від 20% до 300%.
Незважаючи на процедуру відбору, на момент проведення перорального тесту на толерантність до жиру у 3 із 27 пацієнтів були підвищені тригліцериди плазми натще. У наших нещодавніх дослідженнях гіпертригліцеридемічних осіб з маніфестним коронарним атеросклерозом та попереднім інфарктом міокарда була очевидна картина уповільненого кліренсу як тригліцеридів після їжі, так і великих ЛПНЩ. 4 Тому було цікаво відзначити, що три пацієнти з гіпертригліцеридемією в цьому дослідженні могли очищати підвищений рівень ліпопротеїнів після їжі настільки ж ефективно, як і нормотригліцеридемічні чоловіки. Потрібні подальші дослідження, щоб встановити, чи є різниця у складі та метаболізмі багатих тригліцеридами постпрандіальних ліпопротеїнів між суб'єктами гіпертригліцеридемії з явним коронарним атеросклерозом та без нього.
Незважаючи на понад 30 років епідеміологічних та клінічних досліджень, зв’язок між гіпертригліцеридемією, багатими на тригліцериди ліпопротеїнами та ішемічною хворобою серця залишається неясним та багато дискутується. 34 З відповідних рівнів базальної плазми та величин відповідей на споживання жиру, що спостерігаються для залишків хіломікрону та ЛПНЩ у цьому дослідженні, можна зробити гіпотезу про те, що хіломікрони та їх залишки причетні до атерогенезу, перешкоджаючи нормальному опосередкованому LPL катаболізму ЛПДНЩ.
Фігура 1. Лінійний графік тригліцеридів у плазмі крові після прийому жиру у суб'єктів нормотригліцеридемії (n = 24, нижній графік) та гіпертригліцеридемії (n = 3, верхній графік). Значення є середніми ± SEM, при цьому SEM позначається стовпчиками.
Малюнок 3. Графічні ділянки апоВ-100 та апоВ-48 у Sf від 60 до 400 та Sf від 20 до 60 ліпопротеїнових фракцій трьох гіпертригліцеридемічних суб'єктів. Відповідні рівні для нормоліпідемічної групи (суб’єкти контролю) позначаються пунктирними лініями. Контрольні значення є середніми ± SEM, при цьому SEM позначається стовпчиками.
Малюнок 5. Лінійний графік порівняння плазмової концентрації ретинілпальмітату (RP, ○) та приросту апоВ-48 у фракції ліпопротеїну Sf> 12 (•) після вживання жиру. Значення є середніми ± SEM, при цьому SEM позначається стовпчиками.
Таблиця 1. Характеристика суб'єктів, які проходять дослідження обороту in vivo обозначених ретинілпальмітатом багатих тригліцеридами ліпопротеїдів та основні експериментальні умови
RP вказує на ретинілпальмітат; Sf, коефіцієнт флотації Сведберга.
1 Об’єм постпрандіальної плазми, що містить мічені тригліцеридами багаті ліпопротеїди, отримані методом плазмаферезу під час максимальної аліментарної ліпемії та введені через 24 години.
Таблиця 2. Концентрація холестерину та тригліцеридів натще у плазмі та основних фракціях ліпопротеїдів
ЛПНЩ вказує на ліпопротеїни дуже низької щільності; ЛПНЩ, ліпопротеїди низької щільності; і ЛПВЩ, ліпопротеїни високої щільності. Значення середні ± SD; n = 24.
Таблиця 3. Концентрації ApoB-48 і ApoB-100 в плазмі натще у Sf> 400, Sf 60 - 400, Sf 20 - 60 і Sf 12 - 20 Фракції ліпопротеїдів
Sf позначає швидкість флотації Сведберга; Т, слідова кількість (1 Рівень апоВ-48 у цій фракції був
Таблиця 4. Взаємозв'язок між рівнем голодування та постпрандіальним (3-, 6- та 9-годинним) рівнями плазми ApoB-48 та ApoB-100 у фракціях Sf від 60 до 400 та Sf від 20 до 60 у ліпопротеїнових фракціях
Sf вказує коефіцієнт флотації Сведберга. Значення - коефіцієнти рангової кореляції Спірмена.
1 P 2 P
Таблиця 5. Розрахована кількість молекул ретинілпальмітату на одну ApoB-48 –, що містить частинку ліпопротеїну в постпрандіальних Sf> 400, Sf від 60 до 400 та Sf від 20 до 60 фракцій ліпопротеїну
Sf вказує коефіцієнт флотації Сведберга. Значення є середніми ± SD.
Малюнок 2. Топ, графік лінійних концентрацій апоВ-48 у Sf> 400 (•), Sf від 60 до 400 (▪) та Sf від 20 до 60 (▴) фракцій ліпопротеїнів після вживання жиру. Вміст ApoB-48 у фракції Sf від 12 до 20 не показано, оскільки значення були дуже низькими і не змінювались у відповідь на навантаження жиру через рот. Значення є середніми ± SEM, при цьому SEM позначається стовпчиками. Внизу, лінійний графік концентрацій апоВ-100 у фракціях ліпопротеїнів Sf від 60 до 400 (▪), Sf від 20 до 60 (▴) та фракціях ліпопротеїнів Sf від 12 до 20 (○) після вживання жиру. Вміст ApoB-100 у фракції Sf> 400 не показано, оскільки значення були дуже низькими і не змінювалися у відповідь на навантаження жирової тканини через рот. Значення є середніми ± SEM, при цьому SEM позначається стовпчиками.
Малюнок 4. Лінійний графік концентрацій ретинілпальмітату (RP) у фракціях ліпопротеїнів SF> 400 (•), Sf від 60 до 400 (▪) та Sf від 20 до 60 (▴) після вживання жиру. Вміст RP у фракції Sf від 12 до 20 не показано, оскільки значення були дуже низькими і не змінювалися у відповідь на навантаження жирової тканини через рот. Значення є середніми ± SEM, при цьому SEM позначається стовпчиками.
Малюнок 6. Точкові діаграми, що демонструють розпад ретинілпальмітату (RP) у фракціях Sf> 400, Sf від 60 до 400 та Sf від 20 до 60 після ін’єкції міченої RP, після їжі плазми у п’яти суб’єктів. Час 0 - після завершеної інфузії плазми.
Це дослідження було підтримано грантами Шведської ради з медичних досліджень (8691), Шведського фонду серця і легенів, Фонду Маріанни та Маркуса Валленбергів, Фонду короля Густава V до 80-річчя з дня народження, Фонду професора Нанні Сварто, Фонду Північного Інсуліну Шведський фонд маргаринової промисловості для досліджень харчування та Фонд Тюрінга. Доктор Хамстен є кар'єрним слідчим Шведського фонду серця і легенів. Ми вдячні Карін Данелл-Товеруд, Нінні Ерікссон та Аніті Ларссон за експертну технічну допомогу.
- Nestlé Start Healthy Залишайтеся здоровими
- Овочі, смажені в веселці - щіпка здорового
- Нові шоколадні злакові сніданки стверджують, що вони здорові
- Нова серія фільмів підкреслює важливу роль хорошого харчування для здорового старіння
- Фіз Ед Чи можете ви мати зайву вагу і все одно бути здоровими The New York Times