Кількісне відображення РНК-опосередкованого ядерного рецептора ядерного естрогену β в клітинах раку молочної залози людини
Предмети
Анотація
Ядерний рецептор естрогену 2 (ESR2, ERβ) модулює проліферацію ракових клітин і ріст пухлини, виконуючи онкосупресивну роль при раку молочної залози. Протеоміка взаємодії шляхом тандемного очищення спорідненості, поєднаного з мас-спектрометрією, раніше застосовувалася в клітинах ВС для ідентифікації білків, що діють спільно з ERβ для контролю ключових клітинних функцій, включаючи транскрипцію генів, сплайсинг РНК та регуляцію мРНК після транскрипції. Ці дослідження показали участь РНК у складі та функціях інтерактома ERβ. Застосовуючи очищення нативного білкового комплексу з подальшим нано LC-MS/MS до і після в пробірці Видалення РНК, ми створили великий набір нещодавно ідентифікованих ядерних ERβ-взаємодіїв, включаючи підмножину, пов’язану з рецептором через Мост РНК. Ці набори даних будуть корисними для подальшого вивчення ролі ERβ, ядерних РНК та інших білків, ідентифікованих тут у БК та інших типів клітин.
| Тип конструкції | дизайн паралельної групи • дизайн порівняння типів клітин • мета ідентифікації взаємодії білка та РНК |
| Тип вимірювання | виявлення білково-білкової взаємодії |
| Тип (и) технології | нанопотокова рідинна хроматографія-тандемна мас-спектрометрія |
| Тип фактора | генотип • експериментальний стан • біологічна реплікація |
| Зразок характеристики | клітина клітини лінії безсмертної людської грудей |
Передумови та резюме
Ідентифікація та характеристика мультипротеїнових комплексів, що беруть участь у функціях ERβ, є критичним етапом для ідентифікації молекулярних основ його сигналізації в клітинах BC. Протеоміка взаємодії, що поєднує очищення та ідентифікацію нативних білкових комплексів за допомогою мас-спектрометрії, є золотим стандартом для отримання такої інформації, і ми та інші картографували ERβ-взаємодії людських клітин у різних експериментальних умовах 14–19. За допомогою цього підходу ми нещодавно продемонстрували, що ERβ може взаємодіяти з AGO2 в клітинах BC і що це опосередковується однією або кількома РНК 19, що вперше припускає, що РНК відіграє роль у складанні та/або стабілізації взаємодій ERβ, як вже показано для інших ядерних рецепторів 20–22 .
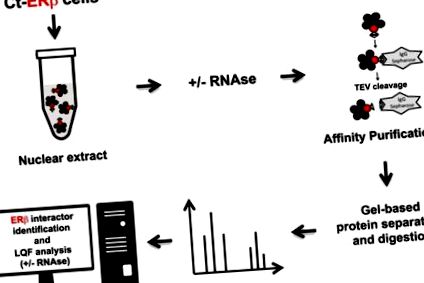
У цьому дослідженні ми створили нові набори даних про взаємодію білків ERβ шляхом очищення природних комплексів, екстрагованих з експресують C-кінцеві ядра ERβ (Ct-ERβ) MCF-7 клітинних ядер до та після обробки РНКазою, з подальшою кількісною кількісною протеомікою (рис. 1). Результати дають розширений погляд на ERβ-ядерний інтерактом клітин BC, включаючи ідентифікацію білково-білкових взаємодій, опосередкованих РНК, які тепер можуть бути використані не тільки для розуміння молекулярних основ активності ERβ, але також функцій всіх інших ідентифікованих білків.
Короткий зміст експериментального робочого циклу, застосованого для формування наборів даних про білки.
(a) Глобальна мережа, що включає всі білки, спеціально спільно очищені з ERβ за допомогою афінної хроматографії та аналізу мас-спектрометрії, демонструючи відомі асоціації, про які повідомляється в базах даних взаємодії білок-білок. Підмережі ERβ-асоційованих білків, що беруть участь у (b) транскрипція та перевірені мережі ядерних рецепторів естрогену, (c) загибель та апоптоз клітин та (d) сплайсинг, отриманий за допомогою аналізу FunRich.
(a) Ділянка вулкана, що підсумовує кількісні зміни ERβ-асоційованих білків при обробці РНКазою. Пунктирна лінія (поріг) представляє межу (q-значення ≤0,05) (b) Теплова карта представлених вниз білків, що показує рівень інтенсивності LFQ до та після обробки РНКазою (шкала блю). Зниження рівня білка (+ проти - RNase) відображаються зеленою шкалою. (c) Аналіз функціонального збагачення за допомогою IPA ERβ-асоційованих білків, взаємодія яких з рецептором була зменшена обробкою РНКазою (верхній гістограма) та збільшення масштабу функціональної категорії "Експресія генів" (нижній гістограма).
Цікаво, що, як відомо, кілька з них беруть участь у контролі експресії генів, клітинного циклу та інших функцій, які, як відомо, є частиною клітинної відповіді на ERβ (рис. 3в).
Представлений тут набір даних буде корисним для дослідження молекулярного механізму активності ERβ та для розробки способів дослідження складу та функціональних ролей макромолекулярних комплексів у ядрах клітин ВС, що містять білки та РНК, спрямований також на ідентифікацію вузлів інтерактома, що представляють потенційні лікарські мішені проти цей та, можливо, інші види раку.
Методи
Екстракція ядерних білків та лікування
Клітини Ct-ERβ 3,14 та ERβ-негативні MCF7 (які позбавляли стероїдів шляхом культивування протягом 5 днів у середовищі без фенолового червоного та з 5% обробленою декстраном деревною вугільною сироваткою), збирали вишкрібанням у холодному PBS та лізували як описані раніше 23. Коротко кажучи, клітинні гранули ресуспендували в 3 обсягах гіпотонічного буфера (20 мМ HEPES pH 7,4, 5 мМ NaF, 10 мкМ молібдату натрію, 0,1 мМ ЕДТА, 1 мМ коктейлю інгібіторів протеази 1Х (Sigma Aldrich) і інкубували на льоду протягом 15 хв. Цитозольну фракцію відкидали після додавання 0,5% Triton X-100 і прядіння протягом 30 с при 15000 X g при 4 ° C.Ядерні гранули потім суспендували в 1 обсязі буфера для ядерного лізису (20 мМ HEPES pH 7,4, 25% гліцерину, 420 мМ NaCl, 1,5 мМ MgCl2, 0,2 мМ EDTA, 1 мМ PMSF та 1X інгібіторів протеази, коктейль (Sigma Aldrich), інкубують протягом 30 хв при 4 ° C, обертаючи та центрифугують протягом 30 хв при 15000 X g при 4 ° C. були остаточно відновлені, розведені 1: 3 буфером ядерного лізису без NaCl для відновлення фізіологічної концентрації сольового розчину та кількісно оцінені.
Очищення ядерних комплексів ERβ
Гранули IgG-сефарози (GE Healthcare), попередньо оброблені відповідно до інструкцій виробника та збалансовані в буфері TEV (50 мМ Tris-HCl рН 8,0, 0,5 мМ EDTA, 0,1% Triton X-100, 150 мМ NaCl, 1 мМ DTT), додавали до ядерних білкових екстрактів і інкубували протягом 3 год при 4 ° C з плавним обертанням, як описано раніше 14,16,23,25,26. Там, де зазначено (див. Таблицю 1), 100 мкг/мл RNaseA додавали до зразків перед зв'язуванням, як описано раніше 19,27. Після інкубації незв’язані білки відкидали після центрифугування, а кульки ретельно промивали 100xVol буфера IPP150 (20 мМ HEPES pH 7,5, 8% гліцерину, 150 мМ NaCl, 0,5 мМ MgCl2, 0,1 мМ ЕДТА, 0,1% Triton X-100) і збалансований в 30xVol буфера TEV в колонках Poly-Prep Chromatography (0,8x4 см, Bio-Rad) при 4 ° C. Потім додавали 4xBeads Vol буфера розщеплення (буфер TEV, що містить 1U/мкл гранул TEV протеази, Invitrogen), і дві наступні реакції розщеплення проводили протягом 2 годин і 30 хв відповідно при 16 ° C з легким струшуванням. Потім елюати збирали після осідання гранул, які все ще зв’язували необрізані та неспецифічні білки.
Nano LC-MS/MS та аналіз даних
Наявність коду
Для контролю якості та аналізу даних було використано наступне програмне забезпечення та версії:
- RSK2 захищає клітини раку молочної залози людини під впливом ендоплазматичного ретикулума шляхом активації
- Збагачена оливковою олією дієта допомагає постраждалим від раку молочної залози втратити більше ваги - ScienceDaily
- Пероральні селективні даунрегулятори рецепторів естрогену (SERD), проривна ендокринна терапія для
- Селективний модулятор рецепторів естрогену сприяє зниженню ваги у самців резус-мавп, що овариектомируются
- Втрата ваги в постменопаузі може зменшити ризик раку молочної залози