Калориметрія Безмежна хімія
Теплоємність - це міра кількості теплової енергії, необхідної для зміни температури чистої речовини на задану кількість.
Мета навчання
Обчисліть зміну температури речовини з урахуванням її теплоємності та енергії, яка використовується для її нагрівання
Ключові винос
Ключові моменти
- Теплоємність - це відношення кількості теплової енергії, переданої об’єкту, до результуючого підвищення його температури.
- Молярна теплоємність - це міра кількості тепла, необхідного для підвищення температури одного моля чистої речовини на один градус К.
- Питома теплоємність - це міра кількості тепла, необхідного для підвищення температури одного грама чистої речовини на один градус К.
Ключові терміни
- теплоємність: Здатність речовини поглинати теплову енергію; кількість тепла, необхідне для підвищення температури одного моля або грама речовини на один градус Цельсія без будь-якої зміни фази.
- питома теплоємність: Кількість тепла, яке потрібно додати або видалити з одиниці маси речовини, щоб змінити його температуру на один кельвін.
Теплоємність
Теплоємність - це внутрішня фізична властивість речовини, яка вимірює кількість тепла, необхідну для зміни температури цієї речовини на задану кількість. У Міжнародній системі одиниць (SI) теплоємність виражається в одиницях джоулів на кельвін [латекс] \ ліворуч (J \ cdot K ^ \ праворуч) [/ латекс]. Теплоємність є великою властивістю, тобто вона залежить від розміру/маси зразка. Наприклад, для зразка, що містить подвійну кількість речовини в порівнянні з іншим зразком, буде потрібно подвоєна кількість теплової енергії (Q) для досягнення тієї ж зміни температури ([латекс] \ Дельта Т [/ латекс]), що і для зміни температура першого зразка.
Молярна та питома теплоємності
Існують дві похідні величини, які визначають теплоємність як інтенсивну властивість (тобто, не залежно від розміру зразка) речовини. Вони є:
- молярна теплоємність, яка є теплоємністю на моль чистої речовини. Молярна теплоємність часто позначається CP, щоб позначити теплоємність в умовах постійного тиску, а також CV, щоб позначити теплоємність в умовах постійного об'єму. Одиницями молярної теплоємності є [латекс] \ frac> [/ латекс].
- питома теплоємність, яку часто просто називають питомою теплоємністю, тобто теплоємністю на одиницю маси чистої речовини. Це позначено cP і cV, а його одиниці наведені в [латекс] \ frac [/ латекс].
Тепло, ентальпія та температура
Враховуючи молярну теплоємність або питому теплоємність для чистої речовини, можна розрахувати кількість тепла, необхідне для підвищення/зниження температури цієї речовини на задану кількість. Застосовуються наступні дві формули:
У цих рівняннях m - маса речовини в грамах (використовується при розрахунку з питомою теплоємністю), n - кількість молей речовини (використовується при розрахунку з молярною теплоємністю).
Приклад
Молярна теплоємність води, CP, становить [латекс] 75,2 \ frac \ cdot K> [/ латекс]. Скільки тепла потрібно для підвищення температури 36 грам води з 300 до 310 К?
Нам дають молярну теплоємність води, тому нам потрібно перетворити дану масу води в молі:
Тепер ми можемо включити наші значення у формулу, яка стосується тепла та теплоємності:
Інтерактив: бачення специфічного тепла та прихованого тепла: Питома теплоємність - це міра теплової енергії, необхідної для підвищення температури даної кількості речовини на один кельвін. Прихована теплота плавлення описує кількість тепла, необхідного для розплавлення твердої речовини. Коли тверда речовина зазнає плавлення, температура в основному залишається постійною, поки вся тверда речовина не розплавиться. Наведене моделювання демонструє питоме тепло і приховане тепло.
Підручник з конкретної теплової потужності: Цей урок пов’язує тепло із зміною температури. У ній розглядається, як кількість тепла, необхідного для зміни температури, залежить від маси та речовини, що бере участь, і ця залежність представлена питомою теплоємністю речовини, С.
Постійнооб'ємна калориметрія
Калориметри постійного об’єму, такі як калориметричні бомби, використовуються для вимірювання теплоти згоряння реакції.
Мета навчання
Опишіть, як працює калориметр бомби
Ключові винос
Ключові моменти
- Калориметр бомби використовується для вимірювання зміни внутрішньої енергії [латексу] \ Delta U [/ латексу] реакції. При постійному обсязі це дорівнює qV, теплота реакції.
- Калориметр має власну теплоємність, що необхідно враховувати при проведенні розрахунків.
Ключові терміни
- бомбовий калориметр: Калориметр бомби - це тип калориметра з постійним об'ємом, що використовується для вимірювання теплоти згоряння певної реакції.
- калорійність: Кількість енергії, необхідної для підвищення температури 1 граму води на 1 ° C. Це одиниця вимірювання енергії, яка не відповідає СІ, еквівалентна приблизно 4,18 Джоуля. Калорія (з великою С) = 1000 калорій.
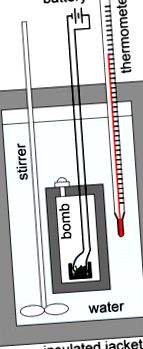
Калориметр бомби
Бомболориметрія використовується для вимірювання тепла, яке реакція поглинає або виділяє, і практично використовується для вимірювання калорійності їжі. Калориметр-бомба - це тип калориметра з постійним обсягом, який використовується для вимірювання теплоти згоряння певної реакції. Наприклад, якби ми були зацікавлені у визначенні вмісту тепла в суші, наприклад, ми б шукали кількість калорій, які він містить. Для цього ми помістимо рулет для суші в контейнер, який називається «бомбою», запечатаємо його, а потім зануримо у воду всередині калориметра. Потім ми евакуювали все повітря з бомби перед тим, як перекачувати чистий кисневий газ (O2). Після додавання кисню запобіжник запалює зразок, змушуючи його горіти, отримуючи тим самим вуглекислий газ, газоподібну воду та тепло. Таким чином, калориметричні бомби побудовані так, щоб протистояти великому тиску, що створюється газоподібними продуктами в цих реакціях горіння.
Калориметр бомби: Схематичне зображення бомбового калориметра, що використовується для вимірювання теплоти згоряння. Зважений зразок поміщають у тигель, який, у свою чергу, поміщають у бомбу. Зразок повністю спалюється в кисні під тиском. Зразок запалюється котушкою запалювання із залізного дроту, яка світиться при нагріванні. Калориметр наповнюється рідиною, зазвичай водою, і ізолюється за допомогою сорочки. Температуру води вимірюють термометром. За зміною температури можна розрахувати теплоту реакції.
Після повного згоряння зразка тепло, що виділяється в результаті реакції, переходить у воду та калориметр. Зміна температури води вимірюється термометром. Загальна кількість тепла, яке виділяється в реакції, буде дорівнює теплу, яке отримує вода та калориметр:
Майте на увазі, що тепло, отримане калориметром, - це сума теплоти, яку отримує вода, а також самого калориметра. Це можна виразити наступним чином:
де Cwater позначає питому теплоємність води [латекс] \ ліворуч (1 \ frac> ^ \ text> \ праворуч) [/ латекс], а Ccal - теплоємність калориметра (зазвичай у [латекс] \ frac><^\text>[/ латекс]). Тому при проведенні експериментів з калориметрією бомб необхідно калібрувати калориметр, щоб визначити Ccal.
Оскільки для калориметра бомби об'єм постійний, робота над тиском обсягу не проводиться. В результаті:
де ΔU - зміна внутрішньої енергії, а qV позначає тепло, поглинене або виділене в результаті реакції, виміряне в умовах постійного об'єму. (Цей вираз раніше було отримано в розділі «Внутрішня енергія та ентальпія».) Таким чином, загальна кількість теплоти, що виділяється в результаті реакції, пов’язана зі зміною внутрішньої енергії (ΔU), а не зміною ентальпії (ΔH), яка вимірюється в умовах постійного тиску.
Цінність таких експериментів не повністю відображає, як наше тіло спалює їжу. Наприклад, ми не можемо перетравлювати клітковину, тому отримані значення потрібно коригувати, щоб врахувати такі відмінності між експериментальними (загальними) та фактичними (що людський організм може засвоїти) значеннями.
Калориметрія постійного тиску
Калориметр з постійним тиском вимірює зміну ентальпії реакції при постійному тиску.
Мета навчання
Обговоріть, як працює калориметр з постійним тиском
- Калориметрія та реакційна ентальпія - хімія LibreTexts
- Підручник з хімії одиниць вимірювання енергії
- Харчова хімія - Як вивести цукор із соку - Обмін стеками хімії
- Харчова калориметрія; Освітня група MRSEC; UW – Медісон
- Визначення ентальпії в хімії та фізиці