Інфекція цитомегаловірусом призводить до дисфункції мікросудин і посилює реакції, викликані гіперхолестеринемією
Михайло Васильович Хоретоненко
* Кафедра молекулярної та клітинної фізіології, Центр наук про здоров'я університету штату Луїзіана, Шривпорт, штат Луїзіана
† Центр молекулярної та пухлинної вірусології, Центр наук про здоров’я Університету штату Луїзіана, Шривпорт, Луїзіана
Ігор Л.Лєсков
* Департамент молекулярної та клітинної фізіології, Центр наук про здоров'я університету штату Луїзіана, Шривпорт, штат Луїзіана
Стівен Р. Дженнінгс
‡ Департамент мікробіології та імунології, Центр наук про здоров’я Університету штату Луїзіана, Шривпорт, Луїзіана
§ Кафедра мікробіології та імунології Медичного коледжу Університету Дрекселя, Філадельфія, Пенсільванія
Андрій Д. Юрочко
† Центр молекулярної та пухлинної вірусології, Центр наук про здоров’я Університету штату Луїзіана, Шривпорт, Луїзіана
‡ Департамент мікробіології та імунології, Центр наук про здоров’я Університету штату Луїзіана, Шривпорт, Луїзіана
Карен Ю. Стокс
* Департамент молекулярної та клітинної фізіології, Центр наук про здоров'я університету штату Луїзіана, Шривпорт, штат Луїзіана
† Центр молекулярної та пухлинної вірусології, Центр наук про здоров’я університету штату Луїзіана, Шривпорт, Луїзіана
Анотація
З точки зору серцево-судинних захворювань також слід зазначити, що ступінь захворювання пов'язана з навантаженням на фактор ризику. 41 Оскільки пацієнти, як правило, не звертаються до кардіолога через CMV-інфекцію, слід враховувати можливість того, що CMV синергізується з іншими факторами серцево-судинного ризику для індукції мікросудинного запалення. Такий сценарій підтверджується дослідженнями, які показують, що інфекція mCMV прискорила розвиток атеросклерозу у гіперліпідемічних мишей. 42–45 У цих дослідженнях використання генетично гіперліпідемічних мишей вимагало введення mCMV, коли вони вже ставали гіперхолестеринемічними, однак більшість людей заражаються CMV протягом раннього дитинства до того, як рівень холестерину в крові циркулює. Тому друга частина нашого дослідження була розроблена для того, щоб визначити, чи посилює попередня наявність інфекції mCMV, спричинену HC, мікросудинну дисфункцію і чи впливає час цієї гіперхолестеринемії щодо інфекції mCMV на цей синергізм.
Матеріали і методи
Вірус
Запас штаму Сміта mCMV вирощували на клітинах NIH3T3. Потім супернатант і вміст клітин очищали і концентрували на градієнті сахарози, і вірус титрували (у вигляді 8 × 10 7 одиниць, що утворюють бляшки), використовуючи стандартний аналіз нальоту на клітинах NIH3T3, як описано раніше, 46 аликвотами і зберігали при - 80 ° C до необхідності. Фіктивний інокулят аналогічно готували з використанням неінфікованих клітин NIH3T3.
Тварини
Тромбоцити
Приблизно 0,9 мл крові збирали від миші-донора через сонну артерію в 0,1 мл кислоти-цитрат-декстрози (Sigma Chemicals Co., Сент-Луїс, Міссурі). Донори тромбоцитів відповідають джерелу реципієнтів з точки зору інфекції та дієти. Тромбоцити виділяли низкою етапів центрифугування та флуоресцентно мітили, як описано раніше. Ця методика не призводить до активації тромбоцитів, як оцінюють за допомогою експресії Р-селектину. 47 Тромбоцити вважалися засолюючими, якщо вони тимчасово робили паузу (≥2 секунди, але 2 .
Експериментальний протокол
Досліджували посткапілярні венули (діаметром 20–40 мкм) зі швидкістю зсуву стінки ≥500/с. Цей поріг був обраний на основі попередніх звітів, що описують схильність лейкоцитів і тромбоцитів до прилипання у венулах при низькій швидкості зсуву стінки. 48 Щоб уникнути упередженості та запалення внаслідок хірургічної травми, для дослідження було обрано венулу з найменшою кількістю прилипаючих та емігруючих лейкоцитів наприкінці 30 хвилин стабілізації. Тромбоцити (10 8, в обсязі 120 мкл) вводили через яремну вену протягом 5 хвилин і давали циркулювати ще 5 хвилин. Однохвилинні записи лейкоцитів (світлова мікроскопія) з подальшим 1-хвилинним записом тромбоцитів (флуоресцентна мікроскопія) були зроблені перших 100 мкм кожні 300 мкм вздовж довжини нестимульованої посудини, починаючи поблизу джерела венулу, наскільки це можливо. Розраховували середнє значення кожної змінної в межах однієї венули та проводили порівняння між експериментальними групами.
Після того, як були зібрані дані про венулах, тваринам давали можливість стабілізуватися протягом 20–30 хвилин, і для дослідження обрали артеріоли з діаметром від 15 до 40 мкм і швидкістю зсуву стінки ≥ 500/с. Діаметр та Vrbc вимірювали на вибраних ділянках до та після суперфузії з 10-5 М ендотелію залежного вазодилататора, ацетилхоліну (ACh), протягом 5 хвилин. Діаметри артеріол дозволили повернутися до вихідних значень за допомогою сольової суперфузії, забуференної бікарбонатом, перед тим, як застосовувати папаверин (папав) для тесту на максимальне незалежне від ендотелію розширення судин. Реакції вазорелаксації артеріолярних судин виражались як відсоток зміни діаметра в порівнянні з вихідним рівнем. Артеріоли, які не реагували на папав, були виключені з дослідження.
Рівні холестерину в сироватці крові
Сироватку заморожували для подальшого вимірювання рівня холестерину за допомогою спектрофотометричного аналізу (Sigma Chemicals Co.).
Кількість клітин крові
В кінці експерименту забирали кров з серця на вміст лейкоцитів (з використанням кришталево-фіолетового забарвлення) та кількості тромбоцитів (із використанням системи унопетт; BD Biosciences, Сан-Хосе, Каліфорнія) за допомогою гемоцитометра.
Аналізи нальоту
Клітини NIH3T3 розмножувались у середовищі DMEM із 10% фетальної бичачої сироватки та 1: 100 пеніциліну/стрептоміцину та пасирували із кратністю 5–10. Для аналізу нальоту на клітинах клітини вирощували до 90% злиття на 48-лункових планшетах для культури тканин. Зразки слинних залоз, печінки, селезінки (первинні органи розповсюдження) та кремастерних м'язів (використовуваних для спостереження за мікросудин) від мишей, інфікованих mCMV ± HC, аналізували за допомогою стандартного аналізу нальоту (4–7 на групу). Тканини зважували та гомогенізували у збалансованому розчині солі Хенкса з 0,1% плодовою бичачою сироваткою (Об'єм [мкл] = маса тканини [мг] × 10), сміття видаляли центрифугуванням та тричі 10-разовими розведеннями супернатантів з кожен зразок додавали до моношарів 3T3 (у двох примірниках). Пластини інкубували при 37 ° C протягом 1–1,5 години, накладали метилцелюлозу, і бляшки підраховували через 4–5 днів після зараження. Як негативний контроль використовували фальшиві середовища та гомогенати макетів. Серійні розведення вірусів з відомим титром та відомі титри вірусів, додані до макетних зразків печінки перед гомогенізацією, використовувались як позитивний контроль (титри вірусів відповідали кількості вірусу, доданого в тканину/лунку).
ПЛР на вірусну ДНК
ПЛР для вірусної ДНК проводили на печінці, селезінці та слинних залозах у мишей mCMV-ND та mCMV-HC через 9 тижнів п.і., що збігалося з максимальною загальною мікросудинною реакцією на інфекцію. Крім того, тестували слинні залози та/або печінку з інших часових точок (6, 7, 13 та 21 тиждень п. І.), Що відповідають кожному окремому піку реакції. Коротко кажучи, загальну ДНК виділяли за допомогою DNeasy Blood and Tissue Kit (Qiagen Inc., Валенсія, Каліфорнія). Потім його аналізували за допомогою ПЛР за допомогою GoTaq Green MasterMix (Promega Corp., Madison, WI) та праймерів для mCMV безпосереднього раннього гена (номер приєднання> M11788) 5′-tca gcc atc aac tct gct acc aac-3 ′ і 5 ′ -Gtg cta gat tgt atc tgg tgc tcc tc tc-3 ′ та мишачий β-актин (номер приєднання> M12481) 5′-gct gta ttc ccc tcc atc gtg-3 ′ та 5′-cac ggt tgg cct tag ggt tca-3 ′. 49 Позитивний контроль включав органи мишей BALB/c через 4 дні на рік, у яких вірусна ДНК була виявлена цим методом.
Статистичний аналіз
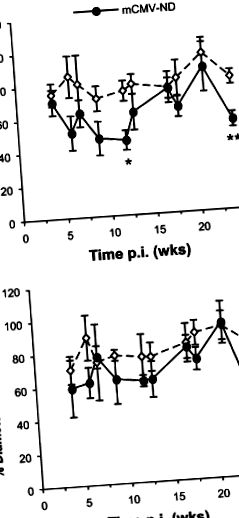
Усі значення подаються як середнє значення ± SEM. Для статистичного порівняння експериментальних груп використовували дисперсійний аналіз з тестом Фішера на постхок, із статистичною значимістю, встановленою на Р (рис. 1А). На відміну від перших кількох місяців на рік, коли індукована папав-дилатацією була порівнянна між імітованими групами та групами mCMV, ці реакції на вазодилатацію також були зменшені через 24 тижні на рік. (Рисунок 1B), приблизно в тій же мірі, що і відповіді на ACh (показано на малюнку 1A), що свідчить про те, що головним чином незалежна від ендотелію вазодилатація відповідає за порушення артеріолярної функції, спричинену інфекцією mCMV, через 6 місяців після первинного впливу.
Реакції артеріолярної вазодилатації на ацетилхолін (ACh) (A) або папаверин (папав) (B) у імітованих або інфікованих mCMV мишей, які підтримували нормальну дієту (ND). Вимірювання (виражене як% зміни діаметра від вихідного рівня) проводили в різні моменти часу між 4 і 24 тижнями p.i. Дані на цьому малюнку - це комбіновані дані ND з обох піддосліджень. * P (Малюнок 2A). Еміграція проходила за аналогічною схемою, з дуже мінливим збільшенням через 7 тижнів p.i. і значне зростання інфільтруючих лейкоцитів на 21 тижні зараження mCMV. Незважаючи на те, що спостерігалася значна різниця, яка також спостерігалася через 13 тижнів, це, мабуть, пояснювалось насамперед низькою еміграцією в контрольних групах Mock-ND (рис. 2B). Адгезія тромбоцитів у посткапілярних венулах не суттєво підвищувалася mCMV у будь-який момент часу під час первинної (дані не наведені) або стійкої інфекції, хоча існувала тенденція до вищої адгезії тромбоцитів на 7 та 13 тижнях п.і. (Малюнок 3С). Це було пов’язано головним чином із збільшенням короткочасної взаємодії (≥2 с, (Малюнок 3А), а не з міцною адгезією (Малюнок 3В) .
Адгезія лейкоцитів у посткапілярних венулах (#/мм 2 поверхня судини) (A) та еміграція в інтерстицій (#/мм 2 інтерстицію) (B), виміряні у мишей, що були інокульовані або інфіковані mCMV, які підтримували нормальну дієту (ND) між 4 і 24 тижнями п.і. Наведені дані - це комбіновані дані від усіх мишей ND у всі часові моменти з двох піддосліджень, які представлені окремо на малюнках 5 і та 7. 7. * Р 2 поверхня посудини). Дані ND, зібрані за всі часові моменти в двох піддослідженнях, представлені тут спільно
Інфекція mCMV посилює та подовжує вплив гіперхолестеринемії на мікросудинні реакції (миші, розміщені на HC через 5 тижнів п.і.)
Артеріолярна функція
Адгезія лейкоцитів (#/мм 2 поверхні судини) (A) та еміграція (#/мм 2 інтерстицію) (B), а також загальна адгезія тромбоцитів (#/мм 2 поверхні судини) (C.) у посткапілярних венулах мишей, яким вводили фальшивий посівний матеріал або mCMV на 0-й день. Мишей або утримували на нормальному чау (ND) протягом усього періоду, або переводили на дієту з високим вмістом холестерину (HC) протягом 5 тижнів п.і. до спостереження на 7, 9, 13, 17 або 21 тижні p.i. Дані тут також представлені на малюнках 2 та 3. 3. * P † P ‡ P § P ¶ P ∥ P (Малюнок 6А). Комбінація mCMV-HC призвела до найгіршого погіршення майже у всі ці часові моменти і була значною порівняно з Mock-ND між 6 та 12 тижнями п.і. Однак це ніколи не досягло значущості порівняно з відповідями у артеріолах mCMV-ND, що свідчить про те, що mCMV є основним фактором, що визначає зміни функції артеріол у мишей рано після гіперхолестеринемії та інфекції. Крім того, зменшене розширення, яке спостерігається у групі mCMV-HC, можна в значній мірі віднести до порушень, що залежать від ендотелію, у всі досліджувані моменти часу, оскільки реакції вазодилатації на папав значно не відрізнялися від відповідей у відповідних групах Mock-ND (Рисунок 6B) .
Вазодилатаційні реакції на ACh (ендотелій-залежний) (A) або папав (не залежить від ендотелію) (B), виміряні в артеріолах мишей протягом 6-місячного періоду після ін'єкції з імітаційним інокулятом або mCMV. Мишей з обох груп підтримували нормальну дієту (ND) протягом усього періоду або переходили на дієту з високим вмістом холестерину (HC) протягом останніх 4 тижнів перед спостереженням на 4, 6, 9, 12, 18 та 24 тижнях п.і. Дані тут також представлені на малюнку 1. * P † P ‡ P § P ¶ P ∥ P (Рисунок 7А) та еміграція (Рисунок 7B) до 6 тижнів, максимум через 9 тижнів, і починаючи падати на 12 тижнів pi, порівняно з усіма іншими групами, досягаючи Mock- Рівні ND до 24 тижнів пі Адгезія швидше зростала і вимагала більше часу, щоб повністю вирішити ситуацію, ніж еміграція. Адгезія тромбоцитів демонструвала приглушену версію картини лейкоцитарних відповідей, при цьому набір тромбоцитів починав зростати через 6 тижнів пі, головним чином через тверду адгезію, яка була значно вищою у мишей mCMV + HC, ніж у всіх інших груп на той момент (Рисунок 7C ). Адгезія тромбоцитів досягла максимуму через 9 тижнів, причому як соління, так і тверда адгезія були значно більшими, ніж контрольні контрольні зразки ND, або миші, що зазнали дії лише одного з факторів ризику. Однак до 12 тижнів p.i., набір тромбоцитів, здавалося, повертався до контрольних значень, і він досяг майже рівня Mock-ND на 24 тижні p.i.
У нашій моделі терміни введення HC мали значний вплив на ймовірність виявлення синергізму між ЦМВ-інфекцією та гострою (4 тижні) гіперхолестеринемією у посткапілярних венулах. Хоча ми не могли визначити, чи пікове запалення корелювало з реактивацією вірусу, вплив цієї різниці у часі може ускладнити виявлення синергізму між CMV-інфекцією та іншими запальними стимулами в дослідженнях, що мали лише кілька часових точок, або в дослідженнях на людях. Це, в свою чергу, може вплинути на нашу інтерпретацію того, посилює чи чи інфікує ЦМВ реакцію на інші подразники. Хоча ми обережно ставимось до екстраполяції цієї залежності від постінфекції на хронічні захворювання, такі як серцево-судинні захворювання, на розвиток яких потрібні десятиліття і при яких кожен фактор ризику зберігається протягом тривалого періоду, це спостереження може мати вплив на сприйнятливість мікросудин, а отже орган (и), до більш гострих травм, таких як ішемія або сепсис.
На закінчення ми наводимо перші докази порушення артеріолярної дисфункції та легких перехідних венулярних запальних та тромбогенних реакцій під час стійкої інфекції mCMV за відсутності інших факторів. Пікові реакції на вірус не збігалися з виявленою реплікацією вірусу. Незалежно від того, чи переривчаста реактивація вірусу на низькому рівні, низькоякісне продовження початкової імунної відповіді на mCMV чи ранні епігенетичні зміни, спричинені mCMV, залишаються незрозумілими. Ми також надаємо докази того, що mCMV не тільки посилює, але і подовжує індуковане гіперхолестеринемією запалення в посткапілярних венулах, і це максимум поряд із тимчасовим набором тромбоцитів. Більше того, терміни введення HC дієти під час зараження mCMV були критичними для початкового продовження індукованого HC захворювання запалення, хоча незрозуміло, чи триває вплив цих термінів протягом хронічного впливу обох подразників. У сукупності ці дані підтверджують епідеміологічні дослідження, що показують зв'язок між ЦМВ та судинною дисфункцією або серцево-судинними захворюваннями, і припускають, що цей вірус може бути можливою терапевтичною мішенню при лікуванні хронічних захворювань у інфікованих осіб.
Подяки
Ми визнаємо допомогу Юніс Джонсон та Кендіс Гамрік у виконанні роботи, яка міститься в цьому рукописі.
- ХЛАМІДІАЛЬНА ІНФЕКЦІЯ, ПЕРОКСИДУВАННЯ ПЛАЗМИ І ОЖИРІННЯ ПРИ ТУБОВОЙ БЕЗПЛОДНОСТІ
- Дозування дифлюкану при дріжджовій інфекції молочних залоз - Медичні кульки
- Диференціальна експресія білка знаменує перехід від зараження Opisthorchis viverrini до
- Кордони Помірне фізичне виховання покращує серцево-судинну дисфункцію, спричинену високим вмістом жиру
- Примітка редактора. Відмова від лікування ожиріння призводить до поганих результатів, навіть у тих, хто здається