Індометацин посилює активність коричневого жиру
Анотація
Вступ
В останні десятиліття ожиріння стало головною проблемою охорони здоров'я в розвинених і навіть у країнах, що розвиваються (Ng et al., 2014). Більше двох третин дорослих американців вважаються надмірною вагою або ожирінням (Flegal et al., 2012). Ожиріння позитивно пов’язане з низкою ускладнень, включаючи діабет 2 типу, серцево-судинні захворювання, хвороби жовчного міхура, остеоартроз та навіть деякі типи раку (Jensen et al., 2014). Вважається, що дисбаланс між споживанням та витратою енергії сприяє ожирінню (Spiegelman and Flier, 2001). Жирову тканину можна класифікувати на білу жирову тканину (WAT) і коричневу жирову тканину (BAT). WAT - головне місце для накопичення енергії, а BAT - основне місце для термогенних витрат енергії шляхом метаболізму глюкози та жирних кислот для отримання тепла. Історично вважалося, що НДТ існує лише у новонароджених людей. Нещодавно розроблені технології, особливо позитронно-емісійна томографія в поєднанні з комп'ютерною томографією, продемонстрували, що дорослі люди мають НДН (Cypess et al., 2009; van Marken Lichtenbelt et al., 2009; Virtanen et al., 2009).
Незважаючи на великі дослідження, Американською адміністрацією з контролю за продуктами та ліками було затверджено кілька препаратів для лікування ожиріння (Narayanaswami and Dwoskin, 2017). На сьогодні затверджені ліки спрямовані на споживання енергії або придушенням апетиту (фентермін), або втручанням в засвоєння поживних речовин (орлістат). Однак ці препарати мають серйозні побічні серцево-судинні та/або психіатричні ефекти, і при припиненні прийому препаратів може виникнути рецидив ожиріння (Kakkar and Dahiya, 2015). Нові дані про роль функціональної НДТ у збільшенні витрат енергії у дорослих людей відкривають новий напрямок терапії проти ожиріння.
Матеріали і методи
Хімічні речовини та реактиви.
Для роботи з культурою клітин індометацин, інсулін, трийодтиронін, розиглітазон та диметилсульфоксид були придбані у Sigma (Сент-Луїс, Міссурі). Первинне антитіло для UCP1 було придбано у Sigma Aldrich, а первинне антитіло для PGC-1α - у Millipore (Темекула, Каліфорнія). ERK1/2 та кон’юговані з пероксидазою хрону козячі анти-кролячі антитіла були придбані у Cell Signaling Technology (Danvers, MA). Для дослідження на тваринах Kolliphor HS15 був подарунком від BASF (Florham Park, NJ), а індометацин був придбаний у Cayman Chemical Company (Ann Arbor, MI).
Культура клітин та лікування.
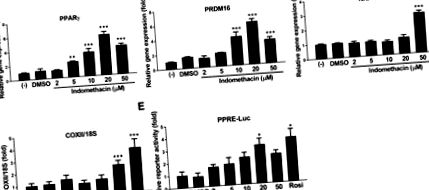
Лінія клітин мишачого коричневого жиру була подарунком доктора Йоханнеса Клейна (Університет Любека, Любек, Німеччина), який створив клітинну лінію з iBAT новонароджених мишей C57BL/6. Коричневі преадипоцити підтримувались у модифікованому середовищем Орла Дульбекко, доповненому 20% фетальною бичачою сироваткою (Atlanta Biologicals, Flowery Branch, GA), при 37 ° C зволоженій атмосфері з 5% CO2 в повітрі, доки вони не досягли злиття (позначеного як день 0). Клітини диференціювали шляхом інкубації в середовищі для диференціювання, що містить модифіковане середовище Орла Дульбекко, доповнене 20% фетальної бичачої сироватки, 1 нМ трийодтироніну та 20 нМ інсуліну, і середовища змінювали через день до 5-го дня. коричневі преадипоцити, індометацин (2, 5, 10, 20 і 50 мкМ) або контрольний носій (диметилсульфоксид) додавали в день 0 і замінювали при кожній зміні середовища в процесі диференціації.
Вестерн-блот-аналіз.
Загальний лізат клітин готували з використанням 1-кратного буфера лізису (Cell Signaling Technology), а концентрації білка визначали за допомогою BCA Assay Kit (Thermo Scientific, Waltham, MA). Загальний лізат клітин піддавали 10% SDS-PAGE і переносили на мембрану полівінілідендифториду (Bio-Rad, Hercules, CA). Мембрану блокували в 20 мМ трис · HCl, 137 мМ NaCl та 0,1% Tween 20 (pH 7,4), що містить 5% знежиреного молока. Мембрану імуноблотували первинними антитілами при 4 ° С протягом ночі, а потім вторинним антитілом, кон'югованим з пероксидазою хрону протягом 1 години. Мембрану виставляли на рентгенівській плівці після розробки посиленими хемілумесцентними реагентами для виявлення вестерн-блот (Pierce, Rockford, IL). Кількісно оцінили сигнал за допомогою денситометрії з використанням системи візуалізації ChemiDocXRS + із програмним забезпеченням ImageLab (Bio-Rad).
Кількісний аналіз ланцюгової реакції полімерази в реальному часі (ПЛР).
Загальну РНК готували з використанням реагенту TRI (Центр молекулярних досліджень, Цинциннаті, Огайо) згідно з інструкціями виробника. Загальну кількість РНК визначали за допомогою спектрофотометра NanoDrop ND-1000 (NanoDrop Technologies, Wilmington, DE). Зворотну транскрипцію проводили з використанням комплекту зворотної транскрипції кДНК високої ємності (Thermo Scientific, Пітсбург, Пенсільванія) відповідно до інструкцій виробника. Експресію мРНК цільових генів та гена ведення домашнього господарства 36B4 вимірювали кількісно, використовуючи PowerUp SYBR Master Mix (Applied Biosystems, Austin, TX). Реакції ПЛР проводили у 96-лунковому форматі, використовуючи прилад ABI 7300HT. Умови циклу становили 50 ° C протягом 2 хвилин та 95 ° C протягом 10 хвилин, а потім 40 циклів при 95 ° C протягом 15 секунд та 60 ° C протягом 1 хвилини. Відносну експресію гена розраховували за допомогою методу 2 ΔΔCt, який нормалізується відносно 36B4. Усі послідовності праймерів наведені в таблиці 1 .
ТАБЛИЦЯ 1
Послідовності праймерів як для коричних преадипоцитів миші, так і для мишей C57BL6
| 36B4 | Вперед: GCGACATACTCAAGCAGGAGCA |
| Реверс: AGTGGTAACCGCTCAGGTGTTG | |
| UCP1 | Вперед: GCTTTGCCTCACTCAGGATTGG |
| Реверс: CCAATGAACACTGCCACACCTC | |
| PGC-1α | Вперед: GAATCAAGCCACTACAGACACCG |
| Реверс: CATCCCTCTTGAGCCTTTCGTG | |
| PPARγ | Вперед: GTACTGTCGGTTTCAGAAGTGCC |
| Реверс: ATCTCCGCCAACAGCTTCTCCT | |
| Prdm16 | Вперед: ATCCACAGCACGGTGAAGCCAT |
| Реверс: ACATCTGCCCACAGTCCTTGCA | |
| Tfam | Вперед: GAGGCAAAGGATGATTCGGCTC |
| Реверс: CGAATCCTATCATCTTTAGCAAGC | |
| Nrf-1 | Вперед: GGCAACAGTAGCCACATTGGCT |
| Реверс: GTCTGGATGGTCATTTCACCGC | |
| ATGL | Вперед: TTGTCCTGCCCCACTAAGAG |
| Реверс: ACTCAGAGAACCCCGTGAAG | |
| HSL | Вперед: AGACACTTCGCTGTTCCTCA |
| Реверс: CTTCAGCCTCTTCCTGGGAA | |
| CPT1 | Вперед: GGACTCCGCTCGCTCATT |
| Реверс: GAGATCGATGCCATCAGGGG | |
| Акад | Вперед: TCAAGATCGCAATGGGTGCT |
| Реверс: GCTCCACTAGCAGCTTTCCA | |
| Плін1 | Вперед: TATGCCCAGAGAGAAGCCTG |
| Реверс: AATCTGCCCACGAGAAAGGA | |
| Плін2 | Вперед: AGCTCCAGACTACATGCCAG |
| Реверс: AGCTTTGACCTCAGACTGCT | |
| Cox4b | Вперед: GGGCAGCTCTGGATAGTTCC |
| Реверс: TCAACGTAGGGGGTCATCCT | |
| CoxII | Вперед: GCTCTCCCCCCTCTCTACGCAT |
| Реверс: AGCAGTCGTAGTTCACCAGG | |
| 18С | Вперед: GATTCTCCGTTACCCGTCAA |
| Реверс: CGTGCTGACGACAGATCACT |
Загальну ДНК готували за допомогою реагенту TRI (Центр молекулярних досліджень) відповідно до вказівок виробника, а концентрації ДНК визначали кількісно за допомогою спектрофотометра NanoDrop ND-1000 (NanoDrop Technologies). Міохондріальну субодиницю 2-оксидази цитохрому С (COXII) та 18S-рРНК-контрольні гени вимірювали кількісно за допомогою PowerUp SYBR Master Mix (Applied Biosystems). Реакції ПЛР проводили у 96-лунковому форматі за допомогою приладу ABI 7300HT (Applied Biosystems, Фостер-Сіті, Каліфорнія). Умови циклу становили 50 ° C протягом 2 хвилин та 95 ° C протягом 10 хвилин, а потім 40 циклів при 95 ° C протягом 15 секунд та 60 ° C протягом 1 хвилини. Відносну експресію гена розраховували за допомогою методу 2 ΔΔCt, який нормалізує відносно 18s рРНК.
Аналізи генів репортерів.
Коричневі преадипоцити, засіяні на 48-лункових планшетах, тимчасово трансфікували репортером PPAR-елемента (PPRE) -люциферази (плазміда адгена №1015) та експресійною плазмідою β-галактозидази з реагентом для трансфекції ліпофектаміну 2000 та реагентом Plus (Thermo Fisher Scientific, Carlsbad, CA) . Після 24 годин трансфекції клітини обробляли індометацином або контролем носія протягом 18 годин. Клітинний лізат готували і вимірювали активність репортерів люциферази та β-галактозидази за допомогою люмінометра GloMax (Promega, Madison, WI). Відносна активність люциферази нормалізувалася за допомогою активності β-галактозидази.
Дослідження на тваринах.
Ліпідний профіль плазми.
Концентрації тригліцеридів у плазмі, загального холестерину, холестерину ліпопротеїдів високої щільності та холестерину ліпопротеїдів дуже низької щільності вимірювали за допомогою аналізатора клінічної хімії AU400 з ферментативними реагентами (Beckman Coulter, Inc., Brea, CA), дотримуючись інструкції AU400. Концентрації холестерину ліпопротеїдів низької щільності розраховували за формулою Фрідевальда. Концентрації нестерифікованих жирних кислот у плазмі крові вимірювали за допомогою набору для кількісного визначення нестерифікованих жирних кислот (ab65341) від Abcam (Кембридж, Массачусетс).
Фарбування H&E.
Тканини фіксували 10% сольовим формаліном, забуференним фосфатом, протягом 48 годин. Фарбування H&E проводилося кафедрою патології Центру наук про здоров’я Техаського університету. Коротко кажучи, парафінові зрізи жирової тканини (5 мкм) депарафінізовували ксилолом і регідратували спиртом. Зразки промивали водою для видалення залишків реагенту, інкубували гематоксиліном II Гілла протягом 4 хвилин, а потім кілька разів промивали водою. Зразки фарбували еозином протягом 1 хвилини. Потім зразки тричі зневоднювали абсолютним спиртом. Нарешті, зразки очищали ксилолом і монтували за допомогою монтажного середовища на основі ксилолу.
Склад тіла.
Склад тіла вимірювали на 0, 2 та 4 тижнях за допомогою аналізатора складу тіла EchoMRI (EchoMRI LLC, Х'юстон, Техас) згідно з інструкціями виробника на тваринницькому об'єкті Техаського університету.
Тест на толерантність до інсуліну.
Після голодування мишей протягом 4 годин на 4 тижні концентрацію глюкози в крові вимірювали за допомогою відрізання хвоста за допомогою глюкометра OneTouch Ultra2 (LifeScan Europe, Цуг, Швейцарія) та тест-смужок. Інсулін (0,75 Од/кг маси тіла) вводили мишам шляхом внутрішньочеревної ін’єкції, а концентрації глюкози в крові вимірювали за допомогою згаданого методу через 15, 30, 45, 60 та 120 хвилин після ін’єкції.
Статистичний аналіз.
Метаболічні ефекти місцевої доставки індометацину до iBAT у мишей із ожирінням.
Індометацин полегшує відбілювання коричневого жиру та підвищену експресію генів, що беруть участь в активації коричневого жиру у ожирілих мишей.
Оскільки індометацин безпосередньо доставлявся до iBAT через осмотичні міні-насоси ALZET, ми спеціально досліджували вплив індометацину на морфологію коричневих адипоцитів та експресію генів-маркерів iBAT. Фарбування H&E клітин iBAT у контрольних мишей мало збільшені крапельки ліпідів та посилене відкладення ліпідів, надаючи видимість відбілювання iBAT (рис. 3А). На відміну від цього, білий фенотип не спостерігався в клітинах iBAT у мишей, оброблених індометацином. Порівняно з контролем, індометацин значно підвищував експресію мРНК UCP1, периліпіну 1 (Plin1) та периліпіну 2 (Plin2) (рис. 3B). Не було значущих відмінностей у інших коричневих маркерах, включаючи Prdm16, PGC-1α, PPARγ, мітохондріальний фактор транскрипції A (Tfam) та Nrf-1 у генах β-окислення жирних кислот, включаючи ацил-кофермент А дегідрогеназу (Acadm) та цитохром c оксидазна субодиниця IV ізоформа 2 (Cox4b), а також у генах ліполізу, включаючи адипоцитарну тригліцерид-ліпазу (ATGL) та гормоночутливу ліпазу (HSL) між мишами, які отримували індометацин та контролювали (Рис. 3B).
- Мірабегрон відхиляє коричневий жир, підвищує обмін речовин - RxList
- Гормон бореться з жиром та жиром. Орексин запобігає ожирінню у мишей, активуючи спалюючи калорії коричневий жир
- БІЛЬШЕ ПРОЦІАЛЬНОЇ ДІЯЛЬНОСТІ ПОТРІБНА У БИТВІ ПРОТИ ОЖИРОСТІ В ЧОЛОВІКАХ - Кірбі - 2009 - BJU
- Виділення фукоксантину та вкрай ненасиченого моногалактозилдіацилгліцерину з бурої водорості Fucus
- Антитіла IgG з пероксидазоподібною активністю із сироватки здорових щурів Wistar - ScienceDirect