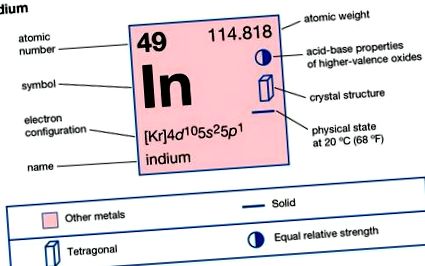
Індій
Наші редактори розглянуть подане вами повідомлення та вирішать, чи слід переглянути статтю.
Індій (в), хімічний елемент, рідкісний метал основної групи 13 (IIIa, або борова група) періодичної системи. Індій має блискучий сріблясто-білий блиск. Це було відкрито (1863) німецькими хіміками Фердинандом Рейхом та Ієронімом Теодором Ріхтером під час вивчення зразків цинкової руди. Наявність переважної спектральної лінії індиго запропонувало назву. Індій м’якший за свинець і досить пластичний. Він може подряпатися нігтем і може зазнати майже безмежних деформацій. Як і олово, чистий метал при нахилі видає високий "крик". Індій зустрічається приблизно так само рідко, як срібло. Земна кора містить у середньому близько 0,05 частин на мільйон індію за вагою. Елемент не зустрічається у поєднанні або в незалежних мінералах, але трапляється у багатьох мікроелементах, особливо цинку та свинцю, з яких він отримується як побічний продукт.
Індій має незвичайну властивість, коли розплав чіпляється за (змочуючи) чисте скло та інші поверхні; це робить його цінним для виготовлення герметичних ущільнень між склом, металами, кварцом, керамікою та мармуром. Індій використовується для покриття підшипників літальних апаратів, оскільки він покращує корозійну стійкість і дозволяє поверхні утримувати більш прилиплу масляну плівку. Це інгредієнт деяких легкоплавких сплавів, що використовуються в спринклерних головках, з’єднувачах протипожежних дверей та плавких пробках. Метал широко застосовується у виробництві напівпровідникових приладів і для пайки різних деталей германієвих транзисторів і випрямлячів. Індій також використовується для вимірювання потоку теплових нейтронів ядерних реакторів та контролю нейтронів для захисту персоналу та обладнання. Природний індій - це суміш двох ізотопів: індію-113 (4,28%) та індію-115 (95,72%).
На метал індію повітря не впливає при звичайних температурах, але при червоному нагріванні він згоряє синьо-фіолетовим полум'ям, утворюючи жовтий оксид In2O3. Цей оксид легко відновлюється до металу, і при сильному нагріванні він втрачає кисень, отримуючи монооксид In2O, де індій знаходиться в стадії окислення +1. Гідроксид індію розчиняється як у кислотах, так і в лугах.
Індій - амфотерний елемент; він розчиняється в кислотах, отримуючи солі індію, а також розчиняється в концентрованих лугах, отримуючи індати. Однак на це не впливає гідроксид калію або окріп. При нагріванні у присутності галогенів або сірки відбувається безпосереднє поєднання. Хоча було підготовлено кілька автентичних сполук індію (наприклад, галогенідів), в яких елемент знаходиться в стадії окислення +1, індій зазвичай відображає в своїх сполуках стан +3. З основними елементами групи 15 (Va) індій утворює сполуки (нітрид індію, фосфід індію, арсенід індію, антимонід індію), які мають напівпровідникові властивості. Розроблені наноструктуровані сполуки індію, включаючи нанотрубки нітриду індію (InN) для високошвидкісних польових транзисторів та світлодіодів (світлодіодів), які можна використовувати на телевізорах та комп'ютерних дисплеях.
Усі безводні тризарядні похідні індію, крім трифториду індію (InF3), є ковалентними. Існує помітна тенденція до того, що два із зовнішніх електронів атома індію (зовнішні 5s 2 електрони) не будуть використовуватися для зв’язування; ця обставина призводить до однозарядних сполук індію.
- Постачальники L-карнітину, Китай Постачальники L-карнітину-TNJ Chemical Industry Co, Ltd
- Мао Цзедун - Британська культурна революція
- N-бутанол, отриманий біохімічними та хімічними шляхами Огляд - ScienceDirect
- Модерація Виклик стихії Землі; Дванадцять річок медицина
- Внутрішньоклітинні Ca2 - та Mn2 - Транспортні АТФази Хімічні огляди