Харчування та дегенерація суглобового хряща
Юзе Ван
Кафедра ортопедії, Друга лікарня медичного університету Шаньсі, 382 Wuyi Road, Тайюань, 030001 Китайська народна республіка Шаньсі
Лей Вей
Кафедра ортопедії, Друга лікарня медичного університету Шаньсі, 382 Wuyi Road, Тайюань, 030001 Китайська народна республіка Шаньсі
Кафедра ортопедії, медична школа Уоррена Альперта Браунського університету/лікарні Род-Айленда, Suite 402A, 1 Hoppin Street, Providence, RI 02903 USA
Лінгюань Цзень
Кафедра ортопедії, Друга лікарня медичного університету Шаньсі, 382 Wuyi Road, Тайюань, 030001 Китайська Народна Республіка
Дундун Хе
Кафедра ортопедії, Друга лікарня медичного університету Шаньсі, 382 Wuyi Road, Тайюань, 030001 Китайська народна республіка Шаньсі
Сяочунь Вей
Кафедра ортопедії, Друга лікарня медичного університету Шаньсі, 382 Wuyi Road, Тайюань, 030001 Китайська народна республіка Шаньсі
Ключова лабораторія Шаньсі з усунення травм кісток і м’яких тканин, 382 Wuyi Road, Тайюань, 030001 Китайська народна республіка Шаньсі
Пов’язані дані
Анотація
Призначення
Визначити важливість синовіальної рідини (SF) або субхондрального кісткового мозку (BM) як джерел живлення при дегенерації хряща.
Методи
Кроликів-самців дев’яносто п’яти місяців випадковим чином розподілили на 5 груп за джерелами харчування: SFBM - обидва; Тільки BM; Лише SF; None-SFBM; та Безкоштовна вилка (необмежена). Харчування циліндричних остеохондральних пробок діаметром 4 мм, створених на трохлеї дистальних відділів стегнових кісток, перешкоджало ковпачку з полівінілхлориду (ПВХ). Зміни хряща оцінювали через 4, 8 та 12 тижнів за допомогою гістології, імуногістохімії та ПЛР у режимі реального часу.
Результати
Найбільший збиток зазнав хрящ у групі, яка мала лише БМ, за якою слідували групи, що не містять SFBM та SF. Апоптоз був збільшений у групах, які мали тільки BM та None-SFBM, порівняно з іншими. Хрящ був значно тонший у всі часові моменти в групах, що мали лише BM і None-SFBM, у порівнянні з SFBM і з Free plug, тоді як у групі, яка використовувала лише SF, ця різниця спостерігалася через 8 тижнів. Порівняно з SFBM-обома та Free plug, експресія колагену II та агреганових мРНК у всіх групах була зменшена, але MMP-3 зросла відповідно.
Висновок
Наші дані вказують на те, що харчування, похідне SF, є основним джерелом живлення для структури та функції хряща дорослих. Пошкодження хряща спостерігається, коли єдиним джерелом живлення є БМ.
Електронний додатковий матеріал
Інтернет-версія цієї статті (doi: 10.1007/s00167-012-1977-7) містить додаткові матеріали, доступні для авторизованих користувачів.
Вступ
Суглобовий хрящ - це безсудинна тканина [15], яка живиться двома потенційними шляхами: дифузією із субхондральних кісткових судин та дифузією із синовіальної рідини. Відносна важливість цих шляхів суперечлива [12]. Зібрані дані свідчать, що дефіцит живлення хряща може бути однією з головних причин дегенерації цієї тканини [10, 14, 15, 25]. Авторадіографічні та трассерні дослідження на тваринах показали, що, хоча незрілий суглобовий хрящ може харчуватися як синовіальним, так і субхондральним шляхом, суглобовий хрящ у зрілих тварин отримує своє харчування виключно із синовіальної рідини через кальцифікованого бар’єру з субхондральним відділом [21–23] . Окрім цього, дослідження на людях Марудаса та Буллоу [20] надали докази, що лише у незрілих зразках людини розчинні молекулярні речовини можуть проникати з порожнини мозку в хрящі. Однак Грінвальд і Хейнс [9] застосовували нетоксичну флуоресцентну та індикаторну технологію для візуалізації руху крові в голові стегнової кістки людини і відзначали, що флуоресцентні речовини в кістковому мозку можуть проникати в тканини хряща у дорослих людей [1, 2, 9].
Хоча ці дослідження припускають, що суглобовий хрящ може харчуватися як субхондральним кістковим мозком, так і синовіальними шляхами, відносна важливість цих двох шляхів залишається невизначеною. Наша гіпотеза полягає в тому, що як шляхи живлення з субхондрального кісткового мозку, так і синовіальна рідина відіграють вирішальну роль у підтримці нормального гомеостазу та функції хряща у дорослих. Метою цього дослідження було визначити взаємозв'язок між харчовими шляхами та дегенерацією суглобового хряща. Щоб визначити, який із шляхів харчування (субхондральний кістковий мозок або синовіальна рідина) відіграє вирішальну роль у підтримці нормального гомеостазу та функціонування хрящової тканини у дорослих, ми позбавили харчування суглобового хряща лише SF, BM лише або обидва SFBM, за допомогою ковпачка з ПВХ. Наслідки депривації харчування оцінювали в різні моменти часу за допомогою грубої томографії, гістологічних аналізів, імуногістохімії та ПЛР у реальному часі.
Матеріали і методи
Тварина модель
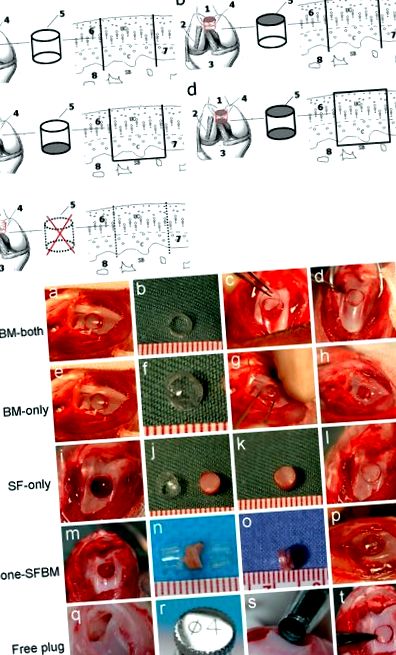
A Діаграма моделі тварин. a SFBM - обидві групи (підтримка харчування як SF, так і BM з відкритою з обох кінців трубкою з ПВХ); b Група, яка має лише ВМ (харчування лише від ВМ, із заблокованою на кінці синовіальної рідини трубкою з ПВХ); c Група, що містить лише SF (харчування лише з SF, із забитою на кінці кісткового мозку трубкою з ПВХ); d Група без SFBM (перешкоджання харчуванню як SF, так і BM, блокуючи обидва кінці трубки з ПВХ); e Безкоштовна група пробок (поживний доступ необмежений, замінюючи остеохондральну пробку, не оточуючи її в ПВХ-трубці); 1. Стегнова кістка. 2. Бічна колатеральна зв’язка. 3. Гомілкова кістка. 4. Стегнова трохлея. 5. ПВХ чашка або трубка. 6. Поверхневий хрящ. 7. Кальцифікований шар. 8. Субхондральна кістка. B Операції на моделях тварин
A Макроскопічний вигляд. B Загальний бал продемонстрував помітне збільшення пошкодження хряща в групах, що мають лише BM та None-SFBM, через 4, 8 та 12 тижнів після операції. Медіани ± інтерквартильний діапазон (M ± QR) зірка P 0,82) та аналіз ділянки Бленда – Альтмана (в межах або менше діапазону ± 1,96 стандартного відхилення) відповідно.
Імуногістохімія
Тільки 4-тижневі зразки використовували для фарбування колагену II типу (Histostain-SP Kits, Zymed, Carlsbad, CA Cat. №95–9943) та ПЛР у режимі реального часу, через те, що зразки хрящів 8 і 12 тижнів були занадто пошкоджені для ці аналізи, особливо у групі, яка має лише ІМ. Зрізи інкубували з моноклональним мишачим Ab проти колагену II типу (20 мкг/мл; Cat. # Cp18 Calbiochem, Японія) при 4 ° C протягом ночі. Зрізи негативного контролю інкубували з контролем ізотипу (25 мкг/мл; Cat. # MAB002 R&D Systems, Inc., Міннеаполіс, Міннесота) в 0,01 М PBS. Потім зрізи обробляли послідовно готовими до використання біотинільованими вторинними антитілами та кон’югатом стрептавідин-пероксидази з подальшим стандартизованим розробкою в DAB. Фотографування проводилося за допомогою Olympus BX51.
Аналіз TUNEL
Апоптоз досліджували за допомогою набору Apop Tag Peroxidase In Situ Detection згідно з інструкціями виробника (Cat. # 11684817910; Roche Diagnostics, Базель, Швейцарія). Зрізи оцінювали два засліплені спостерігачі, використовуючи мікроскоп Olympus BX51 при збільшенні 400 ×. Відсоток позитивно забарвлених хондроцитів розраховували шляхом підрахунку кількості позитивно і негативно забарвлених клітин у кожному слайді.
ПЛР у режимі реального часу
Заморожені зразки хряща (0,5 г) подрібнювали до порошку за допомогою ступки (n = 3, 6 суглобів з обох сторін). Загальну РНК виділяли за допомогою реагенту Trizol (15596–026, INVITROGEN, Карлсбад, Карлсбад, США). Загальний обсяг РНК у мікрограмах був зворотно транскрибований набором синтезу кДНК iScript ™ (K1642, FERMENTAS, MARYLAND, США). Кількісну ампліфікацію ПЛР у режимі реального часу проводили за допомогою набору ПЛР QuantiTect SYBR Green (K0251, FERMENTAS, MARYLAND, США). Рівні мРНК нормалізувались до GAPDH, і обчислення значень іРНК проводили, як описано раніше [29–32]. Значення порогу циклу (Ct) для GAPDH та значення зразків вимірювали та обчислювали за допомогою комп'ютерного програмного забезпечення (IQ50, Bio-Rad, США). Відносні рівні транскрипції були розраховані як x = 2 −ΔΔCt, в яких ΔΔCt = ΔE − ΔC, і ΔE = Ctexp − CtGAPDH; ΔC = Ctctl − CtG. Послідовності праймерів, використовувані для RT-PCR, були наступними: Col-2 прямий 5′-ACACTGCCAACGTCCAGATG-3 ′ і зворотний 5′-GTGAT GTTCTGGGCCCCTC-3 ′ (> D83228); AGG вперед 5′-TCTACCGCTGTGAGGTGAT GC-3 ′ і реверс 5′-TTCACCACGACCTCCAAGG-3 ′ (> L38480); MMP-13 вперед 5′-ACACCGGATCTGCCAAGAGA-3 ′ і реверс 5′-CTGGAGAACGTGATTGGAGT CA-3 ′ (001082037); GAPDH вперед 5′-GGTGAAGGTCGGAGTGAACG-3 ′ і зворотний 5′-AGTTAAAAGCAGCCCTGGTGA-3 ′ (> L23961).
Статистичний аналіз
Таблиця 1
Валовий бал різної групи через 4, 8 та 12 тижнів після операції (M ± QR)
| 4 | 0,0 ± 1,0 | 1,5 ± 1,3 * | 0,5 ± 1,0 | 2,0 ± 1,0 *, ▲ | 0,0 ± 1,0 |
| 8 | 0,0 ± 1,0 | 4,0 ± 1,3 *, ▲ | 1,0 ± 1,3 | 3,5 ± 1,3 *, ▲ | 0,5 ± 1,0 |
| 12 | 1,0 ± 1,0 | 5,5 ± 1,0 *, ▲ | 1,0 ± 2,0 | 4,0 ± 2,3 *, ▲ | 1,0 ± 1,3 |
* P ▲ P 3 A). За оцінкою за шкалою Манкіна, найбільші ураження хряща були виявлені як у лише БМ (14,0 ± 1,0, P 3 B; Таблиця 2) через 12 тижнів.
* P # P ## P 3 D-a, b). Кальцифікований хрящ зник, а хрящ повної товщини втрачений через 12 тижнів. У деяких районах залишковий хрящ був оточений фібрильної тканиною та кістковим мозком (рис. 3 D-c).
Імуногістохімія (IHC) колагену II типу
Сильне фарбування колагеном типу II спостерігалося в групах SFBM - і в групах Free plug. Однак фарбування колагеном II типу було значно нижчим у групах, що мали лише БМ, а потім помірне збільшення забарвлення у групах, які не мали SFM та лише SF. Усі групи лише BM, None-SFBM та SF лише забарвлювали менше колагену типу II, ніж групи SFBM і групи вільних пробок (рис. 4 A).
Таблиця 4
Відсоток апоптотичних хондроцитів на 4, 8 та 12 тижнях у різних групах (середнє значення ± SD)
| 4 | 3,1 ± 0,8 | 39,1 ± 12,6 **, ## | 5,3 ± 1,8 | 40,6 ± 6,4 **, ## | 3,0 ± 1,2 |
| 8 | 3,7 ± 1,7 | 58,5 ± 15,5 **, ## | 16,0 ± 4,1 ** | 52,1 ± 10,0 **, ## | 5,1 ± 2,3 |
| 12 | 4,2 ± 1,8 | 56,3 ± 8,5 **, ## | 15,6 ± 3,9 ** | 59,0 ± 10,5 **, ## | 5,0 ± 2,2 |
* P # P ## P 3 D). Хоча були проведені великі дослідження з метою визначення джерел живлення суглобового хряща та зв'язку між харчуванням та дегенерацією хряща [2, 6, 12, 17], останнє залишається до кінця не зрозумілим [15]. Щоб визначити, яке джерело живлення є найважливішим у підтримці нормального гомеостазу хряща у дорослих, ми розробили новий метод ПВХ-ковпачка, щоб позбавити хрящ харчування від SF або BM (або обох). Наші результати продемонстрували, що цей простий метод був ефективним у блокуванні живлення хряща від SF та BM. Крім того, як продемонстровано відсутністю помітних суттєвих відмінностей у змінах хряща між підставною та SFBM - обома контрольними групами, обидві групи SFBM все ще могли отримувати своє харчування від SF і BM, навіть якщо хрящова пробка була оточена Трубка з ПВХ.
Добре відомо, що суглобовий хрящ може отримувати харчування як з SF, так і з BM [24]. Однак, який шлях є більш важливим для гомеостазу суглобового хряща, все ще залишається аргументом [12, 17]. Наші результати довели, що хрящ може бути пошкоджений блокуванням будь-якого шляху живлення, але блокування шляху SF призвело до значно вищої дегенерації хряща, ніж блокування субхондрального шляху BM. Отже, наші висновки свідчать про те, що суглобовий хрящ живиться переважно із синовіальної рідини.
Найсерйозніші пошкодження хряща спостерігались у групі, яка мала лише БМ, включаючи інвазію крові БМ, зникнення кальцифікованого хряща, пошкодження хряща та оточення залишкового хряща БМ (рис. 2 Aq, Aq, 3A-b, 3 Ab, g, D). Наші дані вказують на те, що СФ може бути домінуючим джерелом харчування, необхідним для підтримки нормальної структури та функції хряща у дорослих. Дефіцит харчування за допомогою SF безпосередньо спричиняє дегенерацію хряща. Коли харчування від СФ було заблоковано, харчування БМ стало домінуючим. Однак, коли БМ став основним джерелом харчування, це призвело до серйозних пошкоджень хряща внаслідок інвазії кровоносних судин з кісткового мозку. Дослідження показали, що дегенерація хряща пов’язана із судинною інвазією [7, 27, 28, 33]. Наш результат узгоджується з цими висновками. Отримані нами дані вказують на те, що модифікація живлення синовіальної рідини або запобігання або блокування інвазії крові з субхондрального кісткового мозку може мати терапевтичний ефект при лікуванні дегенерації хряща.
Помірне пошкодження хряща також було виявлено у групі, яка отримувала лише SF, але ця шкода була меншою, ніж у групі, яка мала лише BM. Цей результат вказує на те, що харчування з кісткового завтра також необхідне для підтримки нормального гомеостазу хряща. Цікаво відзначити, що пошкодження хряща у групі None-SFBM не спричинило подальшого погіршення хряща порівняно з однією лише BM. Одне з можливих пояснень - відсутність інвазії кровоносних судин (рис. 2 A-t, A-t, 3A-e, 3 A-e, j).
Результати ПЛР також довели, що блокування харчування як SF, так і BM призвело до зниження рівня мРНК AGG та Col II, що вказує на те, що харчування як SF, так і BM є критичним для підтримки нормальної функції суглобового хряща. MMP-13 відіграє вирішальну роль у дегенерації хряща, пов'язаної з ОА [29]. У цьому дослідженні ми помітили, що мРНК MMP-13 була збільшена в групах, що містять лише BM, None-SFBM та SF-only, порівняно з групами SFBM і Free, і це вказує на те, що MMP-13 відіграє важливу роль у дегенерація хряща, спричинена позбавленням харчування SF або BM (рис. 5).
Місце для збору зразків хряща є критичним для аналізу товщини хряща, оскільки товщина хряща змінюється з анатомічним розташуванням [5, 26]. Для того, щоб отримати послідовні та порівнянні результати, ми вибрали центр трохлеї стегнової кістки, паралельний верхньому краю бічної зв’язки (рис. 1 A, B) у цьому дослідженні. Підколінно-стегновий суглоб є важливим навантажувальним суглобом у гризунів. Цей суглоб широкий і плоский над верхнім краєм бічної зв’язки. Хрящ із цієї ділянки був однорідним за товщиною в сагітальній площині стегнової кішки. Отже, дані, отримані з цього місця, були послідовними і їх можна порівняти між різними групами.
Висновок
Існує два шляхи живлення суглобового хряща: дифузія із синовіальної рідини або субхондрального кісткового мозку. Харчування із синовіальної рідини має важливе значення для нормальної будови та функції хряща, і втрата цього джерела живлення призводить до набагато серйознішої дегенерації хряща порівняно із втратою живлення з субхондрального кісткового мозку. Крім того, харчування з субхондрального кісткового мозку також необхідне для нормальної будови та функції хряща, а погіршення стану хряща може бути спричинене дефіцитом харчування з боку субхондрального кісткового мозку. Модифікація живлення синовіальної рідини та запобігання інвазії крові з субхондрального кісткового мозку може мати терапевтичний ефект при дегенерації хряща.
- Надзвичайно малі факти харчування Coca-Cola від McDonald s
- Нові та захоплюючі смаки до національного місяця харчування, експериментуйте з травами та спеціями, щоб насолодитись
- Харчування Sago, переваги, недоліки та використання
- Факти харчування великого картоплі фрі від McDonald
- Нове коротке харчування в універсальному охопленні здоров’ям - НД