Харчова глюкоза регулює споживання дріжджів у дорослих чоловіків дрозофіли
Себастьян Лебретон
1 підрозділ хімічної екології, кафедра біології захисту рослин, Шведський університет сільськогосподарських наук, Алнарп, Швеція
Пітер Віцгалл
1 підрозділ хімічної екології, кафедра біології захисту рослин, Шведський університет сільськогосподарських наук, Алнарп, Швеція
Марі Олссон
2 одиниця якості рослинної продукції, кафедра селекції рослин, Шведський університет сільськогосподарських наук, Алнарп, Швеція
Пол Г. Бехер
1 підрозділ хімічної екології, кафедра біології захисту рослин, Шведський університет сільськогосподарських наук, Алнарп, Швеція
Анотація
Налаштування харчової поведінки у відповідь на голод і ситість сприяє гомеостатичній регуляції у тварин. Плодова муха Drosophila melanogaster харчується дріжджами, що ростуть на перестиглих плодах, забезпечуючи поживні речовини, необхідні для виживання дорослих, розмноження та росту личинок. Тут ми представляємо дані про те, як харчова цінність їжі впливає на подальше споживання дріжджів у дорослих чоловіків дрозофіли. Після періоду голодування мухи демонстрували інтенсивне споживання дріжджів. Для порівняння, мухи припинили годування, отримавши доступ до поживної дієти з кукурудзяної муки. Цікаво, що дієтична глюкоза була настільки ж ефективною, як і складна дієта з кукурудзяної муки. Навпаки, мухи, які годували сукралозою, не піддається метаболізму підсолоджувачем, поводились так, ніби їх голодували. Адипокінетичний гормон та інсуліноподібні пептиди регулюють обмінні процеси у комах. Ми не виявили жодного впливу шляху адипокінетичного гормону на цю модуляцію. Натомість у ці зміни брав участь інсуліновий шлях. Мухи без рецептора інсуліну (InR) не реагували на дефіцит поживних речовин, збільшуючи споживання дріжджів. Разом ці результати показують важливість інсуліну в регулюванні споживання дріжджів у відповідь на голодування у дорослих чоловіків D. melanogaster.
Вступ
Механізми, що контролюють споживання їжі та енергетичний гомеостаз, досить добре зберігаються серед видів тварин з хорошою гомологією між хребетними та безхребетними. Після їжі, багатої поживними речовинами, визначається споживання калорій і викликає зворотний зв'язок, який викликає насичення і пригнічує споживання їжі за допомогою гормональних шляхів. У комах центральну роль у регуляції годівлі відіграє інсуліноподібний пептид/адипокінетичний гормон (ILP/AKH), гомологічний шляху інсуліну/глюкагону ссавців (Lee and Park, 2004; Bharucha et al., 2008; Root et al., 2011).
У Drosophila melanogaster прийом їжі сприяє вивільненню непарного 2 (Upd2) з жирового тіла - білка, який, як вважають, є гомологічним лептину ссавців (Rajan and Perrimon, 2012). Upd2 стимулює вивільнення ILP (Rajan та Perrimon, 2012), які діють на нюхові нейрони, інгібуючи короткий нейропептид F (sNPF, гомолог нейропептиду Y), що призводить до зменшення чутливості до запахів, пов’язаних з їжею (Root et al., 2011). На відміну від годування, голодування підвищує фізіологічну чутливість та індукує споживання їжі у комах (Farhadian et al., 2012; Farhan et al., 2013). Збільшення годування принаймні частково зумовлене активністю дофамінергічних нейронів у під-стравохідному ганглії, первинному смаковому центрі (Inagaki et al., 2012; Marella et al., 2012). Вивільнення дофаміну впливає на смакові нейрони, відповідальні за чутливість до цукру, які також експресують рецептори AKH (Bharucha et al., 2008).
Нестача їжі та харчовий склад макроелементів впливають як на фізіологію, так і на поведінку личинок D. melanogaster (Anagnostou et al., 2010; Andersen et al., 2010; Bjordal et al., 2014) та дорослих (Skorupa et al., 2008; Becher et al., 2010; Lushchak et al., 2011; Lebreton et al., 2012). Дієтичні білки активують як ILP, так і AKH шляхи, тоді як дієтичні цукри активують ILP шлях, але інгібують AKH шлях (Buch et al., 2008). ILP та AKH беруть участь не тільки в регуляції годування, але також у кількох поведінкових та фізіологічних особливостях, що залежать від голоду/ситості, у дорослих, таких як мобілізація та зберігання енергії, поглинання поживних речовин у середній кишці, плодючість та розмноження або сексуальна поведінка (Лі and Park, 2004; Bharucha et al., 2008; Liu et al., 2009; Wigby et al., 2011; Kodrík et al., 2012). Вплив дієти, багатої білками, на ці гормональні шляхи добре описаний (Buch et al., 2008). Дріжджі відіграють важливу роль у харчуванні та екології мух (Begon, 1982; Becher et al., 2012), оскільки є важливим джерелом білків (Skorupa et al., 2008), а також ліпідів (Bos et al., 1976 ). Отже, можна очікувати, що мухи, які харчуються на дієті, в якій бракує цих поживних речовин, будуть залучатися до дріжджів, навіть якщо їх попередній раціон був висококалорійним.
Незважаючи на екологічне значення дріжджів, мало відомо про фізіологічні фактори, що регулюють поведінку годування дріжджів у дорослого D. melanogaster. У цьому дослідженні ми досліджували, чи не вплине брак необхідних поживних речовин у дієті на подальшу поведінку дріжджів у годуванні у самців D. melanogaster. Дієтичної глюкози було достатньо для модуляції апетиту, і тому ми дослідили фізіологічні та гормональні механізми, що лежать в основі впливу дієтичного цукру на подальше споживання дріжджів, зосередившись на шляху ILP/AKH.
Матеріали і методи
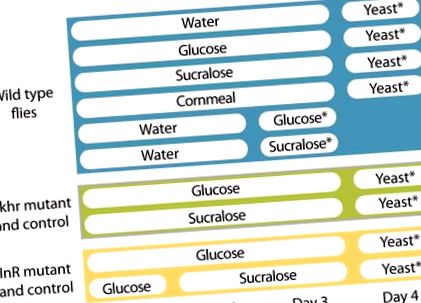
Муха штами і вирощування
Огляд експериментальної конструкції. Зірочками вказується, коли вимірювалось споживання їжі.
Дріжджова культура
Saccharomyces cerevisiae (S288c) вирощували на синтетичному мінімальному середовищі (Merico та співавт., 2007) у 100-мл колбах при 25 ° C на обертовому шейкері протягом 21 год. Суспензію клітин розділяли на порції і витримували при -80 ° C до застосування в аналізі годування.
Аналіз годівлі для споживання дріжджів
Споживання дріжджів аналізували за допомогою модифікованої версії аналізу CAFE (Ja et al., 2007; Farhadian et al., 2012). Окремих чоловіків ізолювали і поміщали в 30-мілілітрову пластикову чашку. Пластикову чашку поміщали на верхню частину скляної пляшки об’ємом 250 мл, наповненої 20 мл дистильованої води. Дно чашки було пробито для забезпечення вологості. Дріжджовий розчин подавали зверху у скляний мікрокапіляр на 5 мкл, утримуваний вирізаним наконечником піпетки. Споживання дріжджів вимірювали кожну годину протягом перших 7 годин та через 24 години (рис. (Рис. 1). 1). Одночасно проводився контрольний експеримент без мух для вимірювання швидкості випаровування дріжджового розчину, який використовувався для корекції норми витрати в експериментах з мухами.
Для того, щоб перевірити кількість цукру (глюкози, сукралози), споживаного мухами, той самий аналіз використовували для 2-денних зголоднілих чоловіків, що спарилися протягом 24 годин. Для кожного випробування використовували дев'ять-одинадцять мух (рисунок (рис. 1 1).
Статистичний аналіз
Для того, щоб перевірити різницю між різними дієтами (вода, кукурудзяна крупа, глюкоза, сукралоза) при годуванні дріжджами протягом 24 год, було проведено багаторазовий тест порівняння (функція glht, пакувальний мультикомплект) на моделі змішаних ефектів з особами та часом як випадковий ефекти (функція lme, пакет nlme). Факторні ефекти аналізували за допомогою F-тесту. Вплив AKHR та InR на споживання дріжджів також аналізували за допомогою моделі змішаних ефектів. Смертність мух InR тестували за допомогою GLM з біноміальним розподілом (вплив дієти та генотипу). Для порівняння мутантних та контрольних мух для кожної дієти використовували χ 2-тест. Статистичний аналіз розраховували з використанням R (R 2.1.1, R Development Core Team, Free Software Foundation, Бостон, Массачусетс, США).
Результати
Дієтична глюкоза модулює поведінку годування дріжджів
Модуляція споживання дріжджів. (A) Вплив дієти глюкози, сукралози, води та кукурудзяної муки на подальше годування дріжджів у дрозофіли протягом 24 годин. (B) Споживання глюкози та сукралози 2-денними голодними мухами. Усі дані є середніми ± SEM.
Шлях інсуліну впливає на споживання дріжджів
Потім ми вивчили, чи бере участь інсулін/АКГ у впливі глюкози на подальшу поведінку годування. Відсутність рецептора AKH у мух Akhr Null не вплинуло на споживання дріжджів у порівнянні з контрольними мухами (Akhr Rev) (F = 0,029, df = 1, p = 0,87), незалежно від дієти (глюкоза або сукралоза) (рис. (Рисунок 3A; 3A; дієта для взаємодії * генотип: F = 0,00006, df = 1, p = 0,99).
Гормональна регуляція поведінки дріжджів під час годування. (A) Роль АКХ та (B) шлях інсуліну при споживанні дріжджів у відповідь на дієтичний цукор. Усі дані є середніми ± SEM.
Навпаки, мутація InR впливала на поведінку годування залежно від попередньої дієти на льоту (рисунок (Рисунок 3B; 3B; дієта взаємодії * генотип: F = 7.04, df = 1, p = 0.012). Дійсно, мутанти InR не реагували до дефіциту поживних речовин (дієта сукралози) за рахунок збільшення споживання дріжджів (рисунок (Рисунок 3B). 3B). Ці мухи також демонстрували більш високий рівень споживання дріжджів при годуванні глюкозою, принаймні протягом перших кількох годин тесту (рисунок (B3B) ). 3В). Крім того, мутанти інсуліну були більш стійкими до голоду (рисунок (рис. 4). 4). При годуванні сукралозою протягом 2 днів 8,3% (1 з 12) мутантних мух InR загинули протягом тестового періоду порівняно з 61,5% (16 з 26) контрольних мух. При годуванні глюкозою всі мухи виживали протягом цього періоду (рис. (рис. 4; 4; дієтичний ефект: розг. = 17,91, df = 1, р 2 = 10,81, df = 1, p = 0,001), але ті, хто вижив, продемонстрували подібну норму споживання дріжджів (0,53 ± 0,16 мкл через 24 год для мух WT (n = 6); 0,46 ± 0,17 мкл для контрольних мух InR (n = 10); Ш = 29, р = 0,86).
Смертність мутантів InR та контрольних мух під час експерименту з годуванням, коли їх раніше годували глюкозою або сукралозою протягом 1 або 2 днів. Зірочки показують різницю в смертності між двома групами мух (Chi 2 -тест, χ = 7,37, df = 1, p = 0,007).
Обговорення
Екологія дріжджів і мух дрозофіл сильно взаємопов'язана. Кілька видів дрозофіл живляться на дріжджах, що ростуть на поверхні гниючих плодів протягом їхнього личинкового та дорослого життя. Позбавлення дріжджів під час розвитку личинок спричиняє різке збільшення смертності (Anagnostou et al., 2010; Becher et al., 2012). Летючі сполуки, що виробляються дріжджами, сильно приваблюють мух дрозофіли у напрямку до бродіння плодів, які становлять субстрат для живлення, спаровування та відкладання яєць (Becher et al., 2012). Взаємно, подорожуючи від фруктів до фруктів, мухи служать вектором для розповсюдження дріжджів (Spencer and Spencer, 1997; Becher et al., 2012).
Дріжджі є основним джерелом білків та ліпідів для мух дрозофіли (Bos et al., 1976; Skorupa et al., 2008). Незбалансована дієта, що містить переважно цукри, призводить до ожиріння короткочасних мух (Skorupa et al., 2008). Додавання дріжджів до незбалансованої дієти протидіє негативному впливу цукру (Skorupa et al., 2008). Тому ми очікували, що чоловіки, які харчуються лише глюкозою, харчуються дріжджами. Однак ці мухи не збільшили споживання дріжджів у порівнянні з мухами, які харчуються багатим середовищем з кукурудзяної муки, що містить дріжджі. Отже, дієтичної глюкози було достатньо, щоб згодом зменшити харчування дріжджів. Дріжджі відіграють важливу роль у плодючості жінки, оскільки стимулюють вироблення яєць (Skorupa et al., 2008). Незважаючи на те, що харчування також впливає на виробництво нащадків та конкурентоспроможність чоловіків (Fricke et al., 2008), позбавлення дріжджів може бути не таким критичним для чоловіків, як для жінок. Дійсно, навіть коли голодують протягом 3 днів, самці дрозофіл здатні спаровуватися і давати стільки ж нащадків, скільки годують самців у неконкурентних умовах (Lebreton et al., 2014). Отже, 3-денний період позбавлення дріжджів може мати незначний вплив на фізичну форму чоловіків. Це пояснювало б, чому чоловіки, які харчуються лише глюкозою, не збільшують споживання дріжджів у наших експериментах.
Використовуючи сукралозу, не підданий метаболізму підсолоджувач (Гордескі-Голд та ін., 2008), ми показали, що ефект цукру не зумовлений механічним зворотним зв’язком годування або солодким смаком глюкози, а скоріше, або його калорійністю значення або до використання глюкози як сигнальної молекули. Мухи дрозофіли здатні визначати калорійність цукру за допомогою незалежного від смаку процесу (Dus et al., 2011) і тому вчаться розрізняти цукру з різними харчовими показниками (Burke and Waddell, 2011; Stafford et al., 2012). Датчик поживних речовин у мозку мухи безпосередньо виявляє підвищення рівня цукру в гемолімфі з різним ефектом у голодуючих та ситих мух (Miyamoto et al., 2012). Було висловлено гіпотезу, що такі ефекти можуть спричиняти такі гормональні шляхи, як передача сигналів інсуліну (Miyamoto et al., 2012).
Шлях інсуліну модулює перевагу їжі у личинок дрозофіли (Wu et al., 2005a, b; Zhao and Campos, 2012). Наші результати показують, що шлях інсуліну також впливає на поведінку годування дріжджами у дорослих. Протилежний ефект інсуліну спостерігався залежно від складу дієти, що свідчить про те, що інсулін може регулювати споживання дріжджів у відповідь як на споживання поживних речовин (годування глюкозою), так і на депривацію (мухи, що годуються сукралозою). Раніше повідомлялося, що нульова мутація субстрату мухи InR chico не впливає на споживання їжі дрозофілою (Wong et al., 2009). Цілком можливо, що шлях інсуліну в основному регулює споживання їжі у відповідь на зміни в доступності поживних речовин, а не модифікує споживання їжі як такої.
При харчуванні глюкозою мутантні мухи InR не пригнічували споживання дріжджів протягом перших кількох годин, припускаючи, що сигнальний шлях інсуліну може відігравати роль у регуляції поведінки годування також у відповідь на споживання поживних речовин. Невдала корекція споживання їжі у відповідь на наявність їжі раніше спостерігалася у мутантних мух на винос (Meunier et al., 2007). Ген, що виводить, кодує передбачуваний білок, що зв’язує юнацький гормон (JH), і бере участь у поведінці та обміні речовин у харчуванні. Подібно до мутантів InR у наших експериментах, мутанти, що вивозять, не збільшують споживання їжі після періоду голодування, а продовжують годувати, коли їжі багато (Meunier et al., 2007). Зв'язок між інсуліном та виведенням незрозуміла, але експресія ilp3 та виведення регулюється одним і тим же чутливим до кальцію та напругою калієвим каналом (SLOB). Мутантні мухи SLOB мають знижений рівень ilp3 і підвищений рівень вивезення (Sheldon et al., 2011). Більше того, нещодавнє дослідження червоного борошняного жука, Tribolium castaneum, показало, що JH регулює стійкість до голоду, регулюючи синтез ILP2 (Xu et al., 2013).
Цікаво, що вивозячі мутанти мають низьку стійкість до голоду (Sarov-Blat et al., 2000). На відміну від вивезення, ми повідомляємо, що мутанти InR мають підвищену стійкість до голоду, підтверджуючи попередні висновки (Broughton et al., 2005). Оскільки мутанти InR не збільшують споживання їжі у відповідь на голод, вони можуть не збільшувати рухову активність, що пов'язано з видобутком їжі у мух WT (Lee and Park, 2004). Збільшення рухової активності призводить до більш швидкого виснаження запасів енергії та збільшує смертність. Підвищена стійкість до голоду спостерігається також у мух із порушеним шляхом AKH (Lee and Park, 2004; Bharucha et al., 2008).
І винос, і Ахр експресуються в смакових нейронах, що виявляють цукри (Meunier et al., 2007; Bharucha et al., 2008). Хоча винос збільшує чутливість цих нейронів після періоду голодування (Meunier et al., 2007), ефект Akhr невідомий. Ми не виявили жодного впливу AKHR на регулювання споживання дріжджів у дорослих мух. Отримані нами результати свідчать про те, що роль АКГ у відповідь на голод може бути в основному обмежена регуляцією метаболізму цукру та ліпідів (мобілізація та зберігання), а не регулюванням поведінки годування. Це на відміну від висновків Bharucha та співавт. (2008), який повідомив, що мутанти AKHR отримують зменшене споживання їжі після періоду голодування. Можливим поясненням розбіжностей між цими двома дослідженнями є те, що Бхаруча та його колеги зосередилися на перших 30 хв після голодування, тоді як ми повідомляємо тут про споживання їжі через 1–24 години після голодування. Тому цілком можливо, що мутанти AKHR починають згодовувати годування після голоду, загальне споживання їжі протягом тривалих періодів не змінюється. Вплив AKH на регуляцію поведінки годування залишається незрозумілим, і будуть потрібні подальші дослідження, щоб розкрити точну роль AKH на споживання їжі.
Підводячи підсумок, це дослідження приносить нові уявлення про те, як модулюється споживання дріжджів, екологічно важливого джерела поживних речовин. Хоча дієтична глюкоза є неповною щодо вмісту необхідних поживних речовин, її, здається, достатньо для зменшення споживання дріжджів у дорослих чоловіків. Встановлено, що інсулін бере участь у регулюванні харчування дріжджів, тоді як ніякого впливу АКГ не виявлено. Ці результати стосуються питання точної ролі шляху інсуліну та АКГ у регуляції взаємодій дрозофіли та дріжджів.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
Подяка
Ми дякуємо Річарду Хопкінсу за корисні коментарі до рукопису та виправлення англійської мови. Це дослідження було підтримане Шведським сільськогосподарським університетом (Марі Олссон та Пітер Вітзгалл - грант KoN) та Шведською дослідницькою радою Formas (Пол Г. Бехер - грант для молодих дослідників).
- Вплив дієтичного олова на метаболізм олова та кальцію дорослих чоловіків
- Дієтичне споживання магнію у французькій дорослій людині SpringerLink
- Споживання дієтичного асортименту продуктів, що знижують рівень холестерину, покращує рівень ліпідів у крові без
- Розширте дієтичне харчування Walmart для чоловіків, що говорять лікарі про еректильну дисфункцію для чоловіків
- Споживання харчової солі та знання, ставлення та поведінка здорових дорослих a