Харчова дієта, що доповнює криль, пригнічує стеатоз печінки у щурів із високим вмістом жиру
Алессандра Феррамоска
1 Кафедра біологічних та екологічних наук та технологій, Університет Саленто, Лечче, Італія,
Анналея Конте
1 Кафедра біологічних та екологічних наук та технологій, Університет Саленто, Лечче, Італія,
Лена Буррі
2 Aker BioMarine ASA, Осло, Норвегія,
К’єтіл Берге
2 Aker BioMarine ASA, Осло, Норвегія,
Франческо Де Нуччо
1 Кафедра біологічних та екологічних наук та технологій, Університет Саленто, Лечче, Італія,
Анна Марія Джудетті
1 Кафедра біологічних та екологічних наук та технологій, Університет Саленто, Лечче, Італія,
Вінченцо Зара
1 Кафедра біологічних та екологічних наук та технологій, Університет Саленто, Лечче, Італія,
Задумав і спроектував експерименти: AF VZ. Виконував експерименти: AF AC FDN AMG. Проаналізовано дані: AF VZ. Внесені реагенти/матеріали/інструменти аналізу: FDN. Написав папір: AF VZ LB KB. Визначено тему дослідження: AF LB KB VZ.
Анотація
Вступ
Дієтичні поліненасичені жирні кислоти (ПНЖК) серії n-3 та n-6 є потужними модуляторами синтезу жирних кислот de novo у печінці [1], [2]. Дійсно, PUFA здатні знижувати як експресію, так і активність ключових ферментів, що беруть участь у цьому анаболічному шляху, таких як цитозольна ацетил-КоА-карбоксилаза (ACC) та синтетаза жирних кислот (FAS), тим самим приводячи до чистого зниження рівня щойно синтезованих жирних кислот усередині гепатоцитів. Крім того, дієта, доповнена n-3 та/або n-6 PUFAs, може благотворно впливати на інші аспекти ліпідного обміну, такі як рівні циркулюючих тригліцеридів та холестерину [3]. Риб'ячий жир (FO), дієтичне масло, збагачене двома довголанцюговими n-3 PUFAs, ейкозапентаеновою кислотою (EPA, 20: 5) та докозагексаєновою кислотою (DHA, 22: 6), справді використовується для профілактики та захисту від серцево-судинних хвороби [4], [5]. Однак останніми роками використання альтернативних дієтичних джерел ПНЖК n-3 швидко поширюється серед населення.
Олія крилю (KO), нова дієтична добавка, видобута з антарктичного крилю (Euphausia superba), також багата EPA та DHA [6]. Однак KO демонструє деякі своєрідні характеристики, які відрізняють його від найбільш часто використовуваних FO. По-перше, більша частина ЕПК та ДГК, що містяться в КО, естерифікуються у формі фосфоліпідів, тоді як у ФО вони входять у тригліцериди [6]. Хоча абсорбція ліпідів тонкої кишки однакова як для фосфоліпідних, так і для тригліцеридних форм, припускають, що вони можуть впливати на розподіл тканин [7] - [11]. По-друге, відношення ЕРА до ДГК вище в КО, ніж у ФО, і по-третє, КО особливо багате антиоксидантом астаксантином, що підвищує його стабільність [12]. Про сприятливий вплив KO в процесі дисліпідемії та запалення повідомляли декілька авторів як у людей, так і у тварин [13] - [16]. Крім того, було продемонстровано вищу ефективність KO у порівнянні з FO у модуляції активності та експресії багатьох ферментів, що беруть участь у метаболізмі ліпідів [17], [18]. Тим не менше, все ще існує потреба у подальших дослідженнях, щоб виявити молекулярні механізми, що лежать в основі оздоровчих ефектів KO.
Ліпогенез печінки, один з анаболічних шляхів, модульованих КО, характеризується складною низкою реакцій, що починаються в матриксі мітохондрій і тривають у цитозолі. Надлишок ацетил-КоА, що утворюється в мітохондріальній матриці і виникає в результаті катаболічної деградації вуглеводів та амінокислот, спочатку включається в цитрат, який згодом експортується з мітохондрій до цитозолю. Мітохондріальний трикарбоксилатний носій або цитратний носій (CIC) каталізує витікання цитрату, тим самим з'єднуючи катаболічні шляхи з анаболічними [19]. Насправді транспортований цитрат регенерує ацетил-КоА в цитозолі, який, у свою чергу, є грунтовкою не тільки для синтезу жирних кислот de novo, але й для біосинтезу холестерину. Отже, білок CIC, поряд з більш дослідженими АСС та FAS, є гарним кандидатом для досліджень, що контролюють можливі зміни в ліпогенезі печінки [20] - [22].
Попередні дослідження підкреслювали участь синтезу жирних кислот de novo у виникненні стеатозу печінки [23], [24]. Цікаво, що повідомлялося, що дієтичні добавки КО здатні зменшувати жирність печінки у мишей [16]. Оскільки нещодавно ми виявили, що КО здатний сильно пригнічувати печінковий ліпогенез у тварин, які харчуються за стандартною дієтою [18], у цьому дослідженні ми дослідили молекулярні механізми, що лежать в основі можливих захисних ефектів КО у тварин, які харчуються з високим вмістом жиру (СН). ) дієта. З цією метою ми ретельно проаналізували кілька ферментативних активностей, що відбуваються в печінці та належать як до анаболічних, так і до катаболічних шляхів. Паралельно ми також спостерігали за змінами різних метаболітів під час обраного дієтичного лікування. Отримані результати змусили нас зобразити можливу структуру для молекулярної дії KO під час цього дисметаболічного стану.
Результати
Вплив дієт на споживання їжі та вагу тіла та печінки
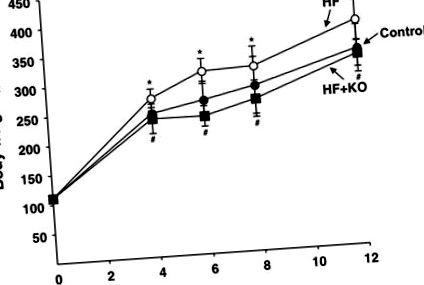
Тварин (самців щурів Sprague-Dawley) випадковим чином розподіляли на три групи та годували контрольною дієтою, ВЧ-дієтою або ВЧ + КО-дієтою протягом 12 тижнів (Таблиця 1). Під час дослідження споживання їжі суттєво не відрізнялося між трьома групами лікування (контрольна група: 11,8 ± 1,8 г/вмирання; група ВЧ: 12,4 ± 0,7 г/вмирання; група ВЧ + KO: 11,8 ± 1,4 г/вмирання). Навпаки, значне збільшення маси тіла щурів, що належать до групи СН, було виявлено вже після 4 тижнів лікування, порівняно з контрольними тваринами (рис. 1). Цей висновок був передбачуваним на основі вищої калорійності ВЧ дієти щодо стандартної дієти (табл. 1). Цікаво, що доповнення дієти з ВЧ 2,5% KO (група HF + KO) суттєво запобігло цьому ефекту (рис. 1). Вага печінки не відрізнявся суттєво між трьома групами жодного разу під час дієтичного лікування (дані не наведені).
Вага тіла щурів, яких годували контрольним (заповнене коло), СН (відкрите коло) та СН + KO (заповнене квадратне), вказували для періодів лікування у тижнях. Кожна точка представляє середнє значення ± SD для 10 тварин. * P # P Контрольна група тварин отримувала стандартну дієту (Global Diet 2018S від Harlan Teklad). Група ВЧ отримувала дієту з 35% жиру (дієта TD.03584 від Харлана Теклада), а група КО годувалась вищезгаданою ВЧ дієтою, доповненою 2,5% КО. Жирні кислоти виділяли з трьох дієт і аналізували за допомогою газорідинної хроматографії.
Печінковий синтез жирних кислот de novo
Транспорт цитрату до мітохондрій печінки щурів, які є свіжовиділеними (A), та у відновлену систему (протеоліпосоми) (B) вимірювали у зазначені моменти часу. Значення, представлені на малюнку, представляють середнє значення ± SD (n = 4). * P # P Таблиця 2). Навпаки, чисте зниження значень Vmax було виявлено в групі HF + KO щодо контрольної групи та групи HF. Добре узгоджуючись із вищезазначеними результатами (рис. 2А та В), аналогічний ступінь гальмування (близько 67%) був виявлений у випадку Vmax після 12 тижнів дієтичного лікування. Ці висновки були повністю підтверджені вестерн-блот-експериментами, в яких експресію мікохондріального CIC контролювали з часом у трьох групах лікування. Зниження активності CIC, виявлене у щурів HF + KO, супроводжувалося значним зменшенням кількості білка-мітохондріального носія у тієї ж групи тварин (рис. 3). Після 12 тижнів дієтичного лікування HF + KO кількість CIC мітохондрій зменшилась на 55% порівняно з контрольними та групами СН. Цікаво, що невелике, хоча і значне зменшення кількості білка CIC також було виявлено на 4-му тижні у групі СН, порівняно з контрольною групою. Ці результати дозволяють припустити, що інгібування CIC внаслідок добавки KO до раціону СН залежить від сильного зниження експресії цього білка-носія мітохондрій. Кількість порину, білка зовнішньої мембрани, перевіреного як контроль, не змінювалося в жодній групі ні на одному етапі лікування.
- Кетогенна дієта з високим вмістом жиру викликає у мишей резистентність до печінки, незважаючи на збільшення енергії
- Адаптація до дієти з високим вмістом жиру прискорює спорожнення жиру, але не вуглеводних тестових страв у людей
- Целастрол покращує метаболічні пошкодження печінки, спричинені дієтою з високим вмістом жиру, через Sirt1 - ScienceDirect
- Чергове денне голодування (АДФ) із дієтою з високим вмістом жиру забезпечує подібне зниження ваги та кардіозахист
- Дієта з високим вмістом жиру може призвести до сонливості вдень - The New York Times