Гіпертрофічна кардіоміопатія при ожирінні, спричиненому дієтою, з високим вмістом жиру: роль придушення фактора транскрипції вилки та транскрипції гена атрофії
Анотація
Підсімейство Foxo факторів транскрипції forkhead, включаючи Foxo1 (FKHR), Foxo3a (FKHRL-1) та Foxo4 (AFX), є ціллю Akt (20). Фосфорилювання Akt призводить до ядерного виключення (інгібування) Foxo. На додаток до добре встановлених клітинних реакцій, викликаних Фоксо, включаючи диференціацію, метаболізм, проліферацію, виживання та атрофію скелетних м'язів (20, 37), цей фактор транскрипції також був показаний при атрофії кардіоміоцитів, що включає підвищення регуляції каскаду атрогенів (36, 37, 46). У скелетних м’язах атрогени контролюються фактором росту, опосередкованим Akt транскрипційною регуляцією факторів Фоксо (35, 37). Нещодавно було продемонстровано, що фактори транскрипції Фоксо експресуються в кардіоміоцитах під регуляцією факторів росту/сигналізації Akt. Foxo може контролювати програму транскрипції атрогену для регулювання розміру міоцитів за кількістю регуляторів серцевої гіпертрофії (40).
Дієтичне харчування з високим вмістом жиру та параметри сироватки.
Ехокардіографічна оцінка.
Геометрію та функції серця оцінювали у знеболених (Avertin 2,5%, 10 мкл/г тіла з масою в/в) мишей за допомогою двовимірної керованої М-ехокардіографії (Phillips Sonos 5500), оснащеної лінійним перетворювачем 15-6 МГц (Phillips Medical Systems, Андовер, доктор медицини). Товщини передньої та задньої стінок та діастолічний та систолічний розміри лівого шлуночка були записані з М-зображень за допомогою методу, прийнятого Американським товариством ехокардіографії. Фракційне вкорочення обчислювали за кінцевим діастолічним діаметром (EDD) та кінцевим систолічним діаметром (ESD), використовуючи рівняння (EDD-ESD)/EDD. Розрахункову ехокардіографічну масу лівого шлуночка (ЛШ) розраховували як [(LVEDD + товщина стінки перегородки + товщина задньої стінки) 3 - LVEDD 3] × 1,055, де 1,055 (мг/мм 3) - щільність міокарда. Частота серцевих скорочень усереднювалась за 10 серцевих циклів (14).
Виділення кардіоміоцитів.
Після седації кетаміну/ксилазину серця видаляли і перфузували бікарбонатним буфером Кребса-Генселейта, що містив (у мМ): 118 NaCl, 4,7 KCl, 1,2 MgSO4, 1,2 KH2PO4, 25 NaHCO3, 10 HEPES та 11,1 глюкози. Серця перетравлювали колагеназою D протягом 20 хв. Ліві шлуночки були видалені та подрібнені перед фільтруванням. Вихід міоцитів становив ~ 75%, на що дієтичне годування з високим вмістом жиру не впливало. Для механічного та внутрішньоклітинного дослідження Ca 2+ були відібрані лише паличкоподібні міоцити з чіткими краями (12).
Вкорочення та подовження клітин.
Механічні властивості кардіоміоцитів оцінювали за допомогою системи м'яких країв IonOptix (IonOptix, Milton, MA). Міоцити поміщали в камеру, встановлену на сцені мікроскопа Olympus IX-70, і суперконфузували (~ 2 мл/хв при 25 ° C) з гідрокарбонатним буфером Кребса-Генселейта, що містить 1 мМ CaCl2. Міоцити стимуляції поля проводили при 0,5 Гц, якщо не зазначено інше. Оцінювали вкорочення та подовження клітин, включаючи пікове вкорочення (PS) - пікове скорочення; час до PS (TPS) - тривалість скорочення; відновлення часу до 90% (TR90) - тривалість релаксації; і максимальні швидкості укорочення/подовження (± dL/dт) - і максимальний розвиток і зниження тиску (12).
Внутрішньоклітинні перехідні процеси Ca 2+.
Когорту міоцитів завантажували фурою 2-АМ (0,5 мкМ) протягом 10 хв, а інтенсивність флуоресценції реєстрували за допомогою системи флуоресценції з подвійним збудженням (Ionoptix). Міоцити поміщали на інвертований мікроскоп Olympus IX-70 і знімали через масляну об'єктив Fluor × 40. Клітини піддавалися впливу світла, випромінюваного 75-ваттною лампою, і пропускали через фільтр 360 або 380 нм, стимулюючи стискатися при 0,5 Гц. Випромінювання флуоресценції було виявлено між 480–520 нм, а якісна зміна інтенсивності флуоресценції фура 2 (FFI) визначалась із співвідношення FFI на двох довжинах хвиль (360/380). Час розпаду флуоресценції (одноразовий або двоекспоненціальний розпад) розраховували як показник внутрішньоклітинного очищення Ca 2+ (12).
Аналіз каспази-3.
Активність каспази-3 визначали за опублікованою методикою (23). Коротко, 1 мл PBS додавали до колби, що містить гомогенати тканини лівого шлуночка, перед центрифугуванням при 10000 g при 4 ° C протягом 10 хв. Надосадову рідину відкидали, а гомогенати лізували в 100 мкл крижаного буфера для лізису клітин (50 мМ HEPES pH 7,4, 0,1% CHAPS, 1 мМ DTT, 0,1 мМ EDTA та 0,1% NP-40). Аналіз проводили в 96-лунковому планшеті, кожна лунка містить 30 мкл клітинного лізату, 70 мкл аналітичного буфера (50 мМ HEPES, 0,1% CHAPS, 100 мМ NaCl, 10 мМ DTT і 1 мМ EDTA) і 20 мкл колориметричного субстрату каспази-3 Ac-DEVD-pNA (Sigma). 96-лунковий планшет інкубували при 37 ° C протягом 1 години, протягом цього часу каспазі у зразку дозволяли відщеплювати хромофор p-NA від молекули субстрату. Поглинання було виявлено при 405 нм з активністю каспази-3, пропорційною кольоровій реакції. Вміст білка визначали методом Бредфорда. Активність каспази-3 виражалася у вигляді пікомолей рНК, що виділяється на мікрограми білка за хвилину.
Аналіз каспази-3/7.
Активність каспази-3 та каспази-7 визначали, використовуючи набір для аналізу гомогенної каспази-3/7 Apo-ONE (Promega, Madison, WI). Каспаза-3 та каспаза-7 є членами сімейства специфічної протеази (каспази) цистеїну аспарагінової кислоти, які відіграють ключову роль в апоптозі в клітинах ссавців. Коротше кажучи, активність каспази-3 та каспази-7 була виявлена в клітинах, які зазнали апоптозу шляхом розщеплення родаміну 110, біс-N-Субстрат аміду CBZ- l-аспартил-l-глутаміл-l-валіл-l-аспарагінової кислоти (Z-DEVD-R110), який існує до проби як профлуоресцентний субстрат. Для проведення аналізу Apo-ONE каспази-3/7 ми змішали і додали буфер каспази-3/7 та субстрат Z-DEVD-R110 до гомогенатів тканини лівого шлуночка. Після послідовного розщеплення та видалення пептидів DEVD за допомогою активності каспази-3 та каспази-7, вихідна група R110 стане інтенсивно флуоресцентною при довжині хвилі збудження 499 нм та довжині хвилі випромінювання 521 нм. Активність каспази-3 та каспази-7 була прямо пропорційна флуоресценції R110 і виражалася як чиста флуоресценція (2).
Ex vivo домінантно-негативна трансфекція Foxo3a та Вестерн-блот-аналіз.
Загальна екстракція РНК, синтез кДНК, зворотна транскрипція та ПЛР у реальному часі.
Аналіз даних.
Дані є середніми ± SE. Статистичне порівняння проводили ANOVA з подальшими тестами Newman-Keuls post hoc. Значимість була встановлена як P 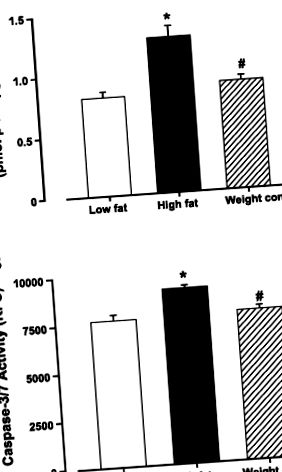
Рис. 1.Вплив дієтичного харчування, що харчується, на апоптоз у лівих шлуночках мишей від груп з обмеженим вмістом жиру, з високим вмістом жиру та з високим вмістом жиру (контроль ваги). A: активність каспази-3. B: активність капсази-3/7. Дані є середніми ± SE; n = 5–6 мишей на групу. *P
Таблиця 1. Біометричні та ехокардіографічні параметри мишей, яких годували з низьким або високим вмістом жиру протягом 6 місяців
Контроль за вагою - це обмеження дієтичного харчування з високим вмістом жиру. EDD, кінцевий діастолічний діаметр; ESD, кінцево-систолічний діаметр; ЛШ, лівий шлуночок. Дані є середніми ± SE; n = ні. тварин.
* P † P 2+ властивості.
Ожиріння, спричинене дієтами з високим вмістом жиру, супроводжувалося значно збільшеною площею перерізу кардіоміоцитів, зменшеною ± dL/dт, і тривалий TPS та TR90 з нормальним PS (рис. 2), дещо нагадує наші попередні знахідки (33). Крім того, кардіоміоцити мишей з ожирінням, що годувались жиром, демонстрували значно підвищений вихідний рівень внутрішньоклітинного Са 2+, пригнічений внутрішньоклітинний підйом Са 2+ у відповідь на електричний стимул (ΔFFI) та зниження швидкості розпаду внутрішньоклітинного Са 2+ (одноразового або двоекспоненційного підгонка кривої; рис. 3). Ці механічні та внутрішньоклітинні дефекти Ca 2+ кардіоміоцитів, пов’язані з ожирінням, спричиненим дієтою, з високим вмістом жиру, значно пом’якшувались за допомогою маневру контролю ваги. Тим не менше, обмеження їжі з високим вмістом жиру злегка, але значно подовжує TR90 і двоекспоненціальне внутрішньоклітинне розпаду Ca 2+, не впливаючи на будь-які інші показники (рис. 2F та 3D).
Рис.2.Скорочувальні властивості кардіоміоцитів із груп дієти з обмеженим вмістом жиру, з високим вмістом жиру та з високим вмістом жиру (контроль ваги). A: площа перерізу. B: пікове вкорочення (нормоване до довжини клітини); C.: максимальна швидкість вкорочення (+ дл/дт). D: максимальна швидкість відновлення (−dL/dт). Е: скорочення часу до піку (TPS). F: відновлення часу до 90% (TR90). Дані є середніми ± SE; n = 75 клітин від 6 мишей на групу. *P
Рис.3.Внутрішньоклітинні перехідні процеси Ca 2+ в кардіоміоцитах із груп з обмеженим вмістом жиру, з високим вмістом жиру та з високим вмістом жиру (контроль ваги). A: інтенсивність флуоресценції фура 2 у спокої (FFI). B: електрично стимульований підйом FFI (ΔFFI). C.: одноразовий експоненціальний внутрішньоклітинний розпад Са 2+. D: двоекспоненціальний внутрішньоклітинний розпад Са 2+. Дані є середніми ± SE; n = 60 клітин від 6 мишей на групу. *P
Експресія Akt, pAkt, Foxo3a, pFoxo3a, гіпертрофічних факторів, MuRF-1 та атрогіну-1.
Дані імуноблотінгу показали, що ожиріння, спричинене дієтами з високим вмістом жиру, значно посилювало базальне фосфорилювання Akt та Foxo3a (показано як абсолютне або нормалізоване фосфорилювання), не впливаючи на загальну експресію білка Akt і Foxo3a. Більше того, ожиріння, пов’язане з дієтою з високим вмістом жиру, скасовувало стимульоване інсуліном збільшення фосфорилювання Akt та Foxo3a (показано як абсолютне або нормалізоване фосфорилювання). Вплив інсуліну не впливав на рівень нефосфорильованих Akt та Foxo3a (рис. 4). Наші дані також показали, що ожиріння, спричинене дієтами з високим вмістом жиру, значно знижує експресію транскрипції атрогенів, включаючи MuRF-1 та атрогін-1. Обидва атрогени демонстрували подібне зниження експресії мРНК на ~ 50%. Крім того, маркери гіпертрофії GATA4 та CNTFR-α були значно підвищені в мишачих серцях після 6 місяців дієтичного годування з високим вмістом жиру. Однак рівень міокарда кальциневрину А та убиквітину не зазнав змін у відповідь на 6 міс дієтичного годування з високим вмістом жиру (рис. 5).
Рис.4.Вестерн-блот-аналіз загального та фосфорильованого Akt та Foxo3a у кардіоміоцитах мишей з низьким вмістом жиру та з високим вмістом жиру у відсутність або наявність стимуляції інсуліном (1,5 од/100 г маси тіла протягом 10 хв). A: усього Акт. B: всього Foxo3a. C.: фосфорильований Akt (pAkt). D: фосфорильований Foxo3a (pFoxo3a). Е: співвідношення pAkt-toAkt. F: співвідношення pFoxo3a до Foxo3a. Вставки: репрезентативні гелі Akt, pAkt, Foxo3a та pFoxo3a з використанням специфічних антитіл. Дані є середніми ± SE; n = 5–8 на групу. *P
Рис.5.A і B: RT-PCR вимірювання атрогіну-1 (A) та конкретний для м’язів КІЛЬЦЕвий палець (MuRF)B) у лівих шлуночках від мишей з низьким вмістом жиру та високим вмістом жиру. C. і D: Вестерн-блот-аналіз гіпертрофічних білків циліарного рецептора нейротрофічного фактора (CNTFR) -α (C.) та GATA4 (D) у лівих шлуночках від мишей з низьким вмістом жиру та високим вмістом жиру. Е і F: Вестерн-блот-аналіз гіпертрофічних білків кальциневрин А (Е) і убиквітин (F) у лівих шлуночках від мишей з низьким вмістом жиру та високим вмістом жиру. Дані є середніми ± SE; n = 4–8. *P
Вплив аденовірусу DN foxo3a на реакцію, викликану пальмітиновою кислотою, на Akt, PTEN та GATA4.
Щоб вивчити причинно-наслідковий зв'язок між зміною Akt-Foxo3a, спричиненою дієтою, та гіпертрофією серця, було проведено дослідження аденовірусної трансфекції ex vivo з метою трансфекції вірусу DN Foxo3a у міобласти H9C2 протягом 6 годин до того, як клітини зазнали впливу пальмітинової кислоти (0,8 мМ) протягом 24 год. Наш аналіз імуноблотингу показав, що пальмітинова кислота значно регулювала гіпертрофічні маркери, включаючи PTEN та GATA4, без явних змін Akt та pAkt. Цікаво, що аденовірус DN Foxo3a імітував підвищену регуляцію GATA4, спричинену пальмітиновою кислотою, не викликаючи ніякого адитивного ефекту з пальмітиновою кислотою. Сам DN Foxo3a викликав регуляцію pAkt та репресію PTEN, ефект якого скасовував пальмітинова кислота (рис. 6). Ці дані свідчать про те, що DN Foxo3a може спричинити фосфорилювання Akt та експресію гіпертрофічного серцевого маркера, що нагадує дієту з високим вмістом жиру та пальмітинову кислоту відповідно.
Рис.6.Вестерн-блот-аналіз загального та фосфорильованого Akt, фосфатази та гомолога тензину (PTEN) та GATA4 у клітинах міобластів H9C2, оброблених 0,8 мМ пальмітиновою кислотою протягом 24 годин. Когорта клітин була трансфікована домінантно-негативним (DN) вірусом Foxo3a (1: 1000) протягом 6 год до впливу пальмітинової кислоти. A: репрезентативні гелеві плями з використанням специфічних антитіл. B: усього Акт. C.: фосфорильований Akt (pAkt). D: співвідношення pAkt-toAkt. Е: PTEN. F: GATA4. Дані є середніми ± SE; n = 6–8 на групу. *P
Одне досить цікаве відкриття нашого дослідження показало, що вірус DN Foxo3a імітував посилене базальне фосфорилювання Akt та гіпертрофічний білок GATA4 при ожирінні, пов'язаному з дієтою. Підвищення регуляції GATA4 при ожирінні, спричиненому дієтою, з високим вмістом жиру синхронізується із зниженням регуляції транскрипції генів, специфічних для атрофії, для сприяння серцевій гіпертрофії та ймовірно гіпертрофічній кардіоміопатії. Це уявлення підкріплюється нашими висновками про те, що пальмітинова кислота безпосередньо сприяла експресії GATA4 в міобластах H9C2. Рівні пальмітинової кислоти, переважної насиченої вільної жирної кислоти, що виділяється з жирової тканини, підвищені при ожирінні та сприяють серцево-судинним ускладненням, пов’язаним з ожирінням (51). Клітинний механізм, відповідальний за транскрипцію генів репресованої атрофії, при ожирінні, спричиненому дієтою, з високим вмістом жиру, до кінця не вивчений, хоча взаємодія між транскрипційним коактиватором PGC-1α (активований проліфератором пероксизоми рецептор-γ коактиватор) та транскрипційним фактором Foxo можуть зіграти свою роль ( 36). Подальше дослідження є необхідним для вивчення регуляції транскрипції генів атрофії після прийому дієти з високим вмістом жиру з ожирінням або без нього.
Наші дані ex vivo також пропонують можливий механізм прямого просування між Akt та його подальшою сигнальною молекулою Foxo3a, оскільки трансфекція мутанта Foxo3a стимулює фосфорилювання Akt. Цей сценарій зворотного зв'язку підтримується уявленням про те, що ген атрофії атрогін-1 інгібує Akt-залежну гіпертрофію серця через убиквітин-залежну коактивацію білків вилки (22). Тим не менше, наше сучасне дослідження не змогло виявити будь-яких змін у експресії убиквітину у відповідь на ожиріння, спричинене дієтами з високим вмістом жиру, не сприяючи деградації білка, пов'язаного з убиквітином, у серцевій гіпертрофії та серцевій дисфункції, пов'язаній з ожирінням, спричиненим дієтою. Убіквітин-протеасома - це бочкоподібна протеаза, здатна розпізнавати та руйнувати білки, прикрашені принаймні чотирма залишками убиквітину (31). Подібним чином, наші дані також вказують на малоймовірну роль кальциневрину в серцевій гіпертрофії та скорочувальній функції при ожирінні, спричиненому дієтою.
Атрогін-1 - це білок F-box, який пригнічує серцеву гіпертрофію, беручи участь в залежному від Akt- та убиквітин-лігази шляху. Як результат, гіпертрофічний промотор кальциневрин може погіршитися. Було висловлено припущення, що атрогін-1 не впливає на саму активність Akt, а скоріше служить коактиватором для членів факторів транскрипції форхеда нижче за Akt (22). Миші з надмірною експресією серцевого атрогіну-1 виявляли регульовані фактори транскрипції форххедів, супутні придушенню серцевої гіпертрофії, тоді як миші, у яких відсутній атрогін-1, демонстрували протилежний фізіологічний фенотип, припускаючи, що атрогін-1 може порушити серцеву гіпертрофію через свій вплив на фактори транскрипції форхед (22 ). Це поняття підтверджується нашими експериментальними даними пригніченої експресії мРНК атрогіну-1 та підвищеного базального фосфорилювання Foxo3a (менша експресія активного фактора транскрипції), хоча цей процес може бути незалежним від системи убиквітин-протеасома та кальциневрину.
Експериментальні обмеження
На закінчення наше дослідження запропонувало докази того, що геометричні, скорочувальні та міокардіальні скорочення Са 2+ при ожирінні, спричиненому дієтою, з високим вмістом жиру можуть бути пов’язані із пригніченим фактором транскрипції вилок (підвищене базальне фосфорилювання Foxo3a) та специфічною для атрофії транскрипцією генів. У світлі ефекту аденовірусу DN Foxo3a на фосфорилювання Akt та регуляцію гіпертрофічних білків, що нагадують дієту з високим вмістом жиру або пальмітинову кислоту, наші дані підтверджують нову гіпотезу про ожиріння, спричинене дієтами з високим вмістом жиру (можливо, резистентність до інсуліну та діабет 2 типу). ) пригнічує фактор транскрипції forkhead через хронічну активацію Akt. Хронічна активація Akt здатна замінити програму зростання, викликану Foxo. Подібним чином інші гіпертрофічні агоністи, такі як ангіотензин II, можуть викликати інактивацію білків Foxo у кардіоміоцитах за допомогою механізму, залежного від фосфатидилінозитол-3-кінази/Akt. Обов’язково слід уважно вивчити роль факторів транскрипції Akt-forkhead у ожирінні та індукованій діабетом гіпертрофії серця та гіпертрофічній кардіоміопатії, щоб можна було досягти оптимальних терапевтичних стратегій, спрямованих на цей сигнальний каскад.
Цю роботу підтримали частково Американська асоціація сердець Тихоокеанського регіону (# 0355521Z) та Національний інститут охорони здоров’я Університету Вайомінгу, Північні Скелясті гори, Регіональний інституційний розвиток, Мережа біомедичних досліджень (# 5P20RR016474).
СНОПКИ
Витрати на публікацію цієї статті були частково сплачені за рахунок оплати сторінок. Тому стаття має бути позначена цим «реклама”Відповідно до 18 U.S.C. Розділ 1734 виключно для зазначення цього факту.
Ми вдячні доктору Джи Лі за щедру підтримку, а також докторам. Кунь Лі та Наїр Среджаян за допомогу у дослідженні трансфекції Foxo3a.
- Втрата ваги швидше, ніж пізніше дає найкращі шанси змінити пошкодження серця від ожиріння,
- Гормон бореться з жиром та жиром. Орексин запобігає ожирінню у мишей, активуючи спалюючи калорії коричневий жир
- Як схуднути взаємодія гормонів та ожиріння
- Як навантажувати вагу в блоці драконів C diet Дієтичні таблетки для боротьби із ожирінням та сприяють зниженню ваги
- Втрата ваги швидше, ніж пізніше, дає найкращий шанс змінити пошкодження серця від ожиріння