Функції мітохондріальної 2 ′, 3′-циклічної нуклеотид-3′-фосфодіестерази та перспективи її майбутнього
Крестініна Ольга
1 Інститут теоретичної та експериментальної біофізики Російської академії наук, м. Пущино, 142290 Московська область, Росія; ur.relbmar@luyb
Бабуріна Юлія
1 Інститут теоретичної та експериментальної біофізики Російської академії наук, м. Пущино, 142290 Московська область, Росія; ur.relbmar@luyb
Пападопулос Василіос
2 Кафедра фармакології та фармацевтичних наук, Фармацевтична школа, Університет Південної Каліфорнії, Лос-Анджелес, CA 90089, США; ude.csu@podapapv
Анотація
2 ′, 3′-циклічний нуклеотид-3′-фосфодіестераза (CNPase) - це пов’язаний з мієліном фермент, який каталізує гідроліз фосфодіефіру 2 ’, 3’-циклічних нуклеотидів до 2’-нуклеотидів. Однак його наявність виявляється також у немієлінованих клітинах та інших клітинних структурах. Розуміння його специфічних фізіологічних функцій, особливо в немієлінованих клітинах, все ще є неповним. Цей огляд концентрується на ролі мітохондріальної CNPase (mtCNPase), незалежної від мієліну. mtCNPase здатний регулювати функціонування перехідної пори мітохондріальної проникності (mPTP) і, отже, бере участь у механізмах загибелі клітин, як апоптозу, так і некрозу. Також розглядається його участь у розвитку різних захворювань та патологічних станів, таких як старіння, хвороби серця та алкогольна залежність. Таким чином, mtCNPase можна розглядати як потенційну мішень для розробки терапевтичних стратегій у лікуванні захворювань, пов'язаних з мітохондріями.
1. Вступ
У центральній нервовій системі ссавців та деяких хребетних рясно присутній асоційований з мієліном фермент 2 ', 3'-циклічний нуклеотид 3'-фосфодіестераза (CNPase, EC3.1.4.37). Відомо, що CNPase здатний каталізувати гідроліз 2 ’, 3’-циклічних нуклеотидів з утворенням 2’-нуклеотидів in vitro [1], проте фізіологічний субстрат in vivo досі незрозумілий. Крім того, повідомлялося, що фермент був присутній у різних інших типах клітин, хоча і на нижчих рівнях [2,3], та в немієлінових мембранних препаратах із селезінки, печінки, тимусу, надниркових залоз, нирок, серця та скелетних м’язів [4,5,6]. Також спостерігалося, що CNPase асоціюється з мітохондріями в клітинах надниркових залоз [7].
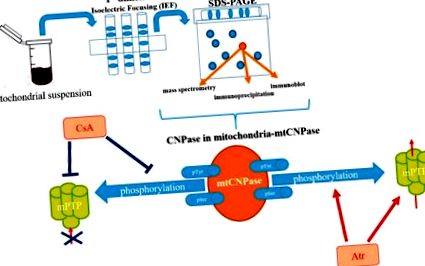
2. Виявлення mtCNPase
Схематичне зображення виявлення mtCNPase в мітохондріях.
3. Партнери взаємодії mtCNPase
Дайєр та співавтори показали, що CNP-аза локалізована як з цитоскелетом на основі актину, так і з цибулером на основі тубуліну в культивованих олігодендроцитах. [21]. Пізніше Де Анджеліс і Браун виявили, що CNPase насправді пов'язана з цитоскелетом на основі актину [23]. Додаткові біохімічні докази взаємодії CNPase-тубулін були отримані під час спостереження, що мікротрубочки в культивованих клітинах щитовидної залози дисоціювали від плазматичної мембрани після обробки ловастатином, сполукою, яка інгібує ізопренілювання. Оскільки функція тубуліну не вимагає ізопренілювання, це припускає, що ізопренільований білок-лінкер повинен бути відповідальним за прикріплення до мембран мікротрубочок. Такий ізопренільований білок з молекулярною масою 48 кДа пізніше був ідентифікований як CNPase [24]. Також було встановлено, що CNPase не тільки асоціюється з мікротрубочками в культивованих клітинах щитовидної залози щурів та тканинах головного мозку, але також спільно очищається мікротрубочками навіть після послідовних циклів полімеризації та деполімеризації. Таким чином, CNPase було визначено як білок, асоційований з мікротрубочками, який також має полімеризаційну активність мікротрубочок in vitro [25].
Повідомлялося, що mtCNPase специфічно асоціюється з ADAP1, специфічним для головного мозку білком (відомим нещодавно як p42 IP4 або Кентаврин-α1) та α-тубуліном у RBM [26]. Цікаво, що в мітохондріях асоціації ADAP1 з mtCNPase, ADAP1 з α-тубуліном та mtCNPase з α-тубуліном були підтверджені експериментами з ко-імунопреципітацією [26]. Ко-імунопреципітація може сприйматися як ознака взаємодії in vivo між відповідними білками. Важливо, що було виявлено, що імунопреципітат ADAP1 від RBM містив імунореактивні смуги як для mtCNPase, так і для антитіл до α-тубуліну. Імунореактивні смуги не спостерігались у імунопреципітатів, отриманих з антитілами до контролю ізоформи CNPase на основі мієліну. Специфічність спільного імунопреципітації ADAP1 з α-тубуліном та mtCNPase підтверджена імунофарбуванням антитілом АНТ. Таким чином, можна зробити висновок про утворення комплексу in vivo між ADAP1, mtCNPase та α-тубуліном у RBM. Залучення ADAP1 та mtCNPase у розкриття mPTP, спричинене Ca 2+, було продемонстровано незалежно в ізольованих мітохондріях з різних клітин [16,26]. Тому представляє великий інтерес зрозуміти, які функціональні наслідки мають комплекс, що містить ADAP1, mtCNPase та α-тубулін, що утворюються in vivo в RBM.
Повідомляється, що mtCNPase локалізована як на внутрішній, так і на зовнішній мембранах мітохондрій, ефективно розміщуючи її між собою (рис. 2) [16]. Ця знахідка спонукала нас шукати білки, що взаємодіють з mtCNPase, в межах контактних місць, де розташований комплекс mPTP. АНТ і залежний від напруги аніонний канал (VDAC) раніше вважалися компонентами комплексу mPTP. Однак генетичні дослідження показали, що для складу mPTP не потрібні VDAC і ANT [27,28], проте VDAC і ANT все ще вважаються регуляторами/модуляторами mPTP [29,30,31]. Однак циклофілін D (CyP-D) - це білок мітохондріального матриксу, який розглядається як один з найважливіших елементів функціонування mPTP [32]. Було показано, що mtCNPase осідає з основними регуляторами mPTP, такими як CyP-D, VDAC та ANT [33]. Виявлення того, що mtCNPase колокалізована з CyP-D, ANT та VDAC, а також з α-тубуліном у мітохондріях, завантажених та розвантажених Ca 2+, вказує на можливе фізичне зв'язування між цими білками в мітохондріях.
Схематичне зображення ролі mtCNPase у функції mPTP.
У зовнішній мітохондріальній мембрані mtCNPase може взаємодіяти з VDAC, який є основним білком зовнішньої мембрани, який бере участь у проникності зовнішньої мітохондріальної мембрани. VDAC може бути у відкритому або закритому стані. У закритому стані VDAC його канал є більш проникним для Ca 2+ [34], так що може привести до прискорення відкриття mPTP, а зв’язування α-тубуліну з VDAC полегшує його закриття [35]. Оскільки VDAC і mtCNPase пов'язані з α-тубуліном, провідність VDAC може регулюватися безпосередньо mtCNPase або за допомогою зв'язування α-тубуліну, що дозволяє модулювати проникність зовнішньої мембрани.
Асоціація mtCNPase з комплексами I, V, III та II у МРК, навантаженому Ca 2+, показала, що mtCNPase може існувати у вільній формі та може виділятися з мітохондрій разом із цитохромом c та іншими апоптотичними факторами. Відкриття mPTP сприяло вивільненню mtCNPase з RBM, подібно до вивільнення цитохрому c, AIF та Endo G. Крім того, в умовах перевантаження Ca 2+ 2 ′, 3′-цАМФ сприяє регульованому вивільненню mtCNPase, AIF та Endo G, хоча це не впливає на вивільнення цитохрому c. Кореляція між вивільненням mtCNPase та AIF та Endo G вказує на можливий зв’язок mtCNPase з незалежним від каспази шляхом апоптозу [33].
4. Участь mtCNPase у регулюванні відкриття mPTP, спричиненого Ca 2+
Таблиця 1
Вплив нокдауну CNPase на функціональні параметри мітохондрій при розкритті mPTP, спричиненому Ca 2+.
| Дикий тип | 1,00 ± 0,11 | 1,00 ± 0,06 | 1,00 ± 0,14 |
| Шифрована міРНК | 0,97 ± 0,10 | 0,85 ± 0,08 | 0,98 ± 0,05 |
| СіРНК CNPase | 0,87 ± 0,13 | 0,66 ± 0,09 ** | 0,68 ± 0,11 * |
* Швидкість напливу р 2+ спостерігалася в мітохондріях, виділених з різних типів клітин. Однак для збитих мітохондрій CNPase виявлено знижену здатність Ca 2+ (приблизно 30%) та фазу відставання (приблизно 40%) [16]. Таким чином, рівень білка mtCNPase в мітохондріях виявляється важливим для регуляції розвитку mPTP, спричиненого Ca 2+.
CNPase гідролізує 2 ’, 3’-циклічні нуклеотиди до відповідних їм монофосфатів [1]. Ми також повідомляли про вплив субстратів CNPase, 2 ′, 3′-циклічних нуклеотидів на функцію мітохондрій [16]. 2 ′, 3′-cAMP та 2 ′, 3′-cNADP суттєво посилювали відкриття mPTP, спричинене Ca 2+. Цей ефект спостерігався при транспортуванні Са 2+, розсіюванні потенціалу мембрани та набряканні RBM. Обидва субстрати CNPase змогли зменшити фазу запізнення та збільшити швидкість відтоку Ca 2+ з RBM при розкритті mPTP, індукованому Ca 2+ [16]. Ферментативна активність mtCNPase знижувалась під впливом Ca 2+, відкритого mPTP, і запобігався гідроліз 2 ’, 3’-циклічних нуклеотидів [16]. Отже, ефективність дії 2 ′, 3′-cAMP та 2 ′, 3′-cNADP щодо стимулювання розкриття mPTP шляхом індукції Ca 2+ -індукції у петлі зворотного зв’язку була збільшена (рис. 2). Тому було запропоновано, щоб у живих клітинах інгібування активності mtCNPase при індукованому Ca 2+ розкритті mPTP в мітохондріях сприяло підвищенню рівня 2 ′, 3′-циклічного нуклеотиду. Таким чином, субстрати CNPase, як 2 ′, 3′-cAMP, схоже, працюють як другі месенджери, сприяючи відкриттю mPTP в мітохондріях [16].
5. CNPase в патології та старінні
5.1. CNPase в патології та старінні
Підвищений когнітивний дефіцит, який може бути пов'язаний з вразливістю мієлінових нервових волокон, відбувається при нормальному старінні. Також відомо, що зі старінням мозку в ключових білках мієліну, включаючи CNPase, відбуваються вікові зміни. Це, зокрема, призводить до порушення когнітивних функцій [50]. Втрата нервових волокон і зміна структури мієліну призводять до неефективної провідності нейрональних сигналів під час старіння. CNPase, один з найпоширеніших білків мієліну, може відігравати важливу роль у підтримці цілісності мієліну та аксона з віком [51].
Попереднє обговорення стосувалося лише участі мієлінової CNPase у механізмах, що лежать в основі старіння та патологій центральної нервової системи. Однак протягом останніх років з'явилися численні дослідження, які показують, що CNPase, присутня в немієлінізованих тканинах і клітинах, також відіграє важливу роль у патогенезі різних захворювань, особливо через мітохондрії, про що йдеться в наступному розділі.
5.2. mtCNPase у старінні
Роль CNPase в мітохондріях у старінні.
5.3. CNPase і рак
Як уже згадувалося раніше, CNPase бере участь у розвитку запалення в клітинах нейронів [45], а хронічні інфекції та запалення вважаються факторами ризику розвитку раку [57]. З іншого боку, mtCNPase бере участь у функціонуванні mPTP і, таким чином, передбачається, що він відіграє роль в апоптозі [16]; тому було б цікаво оцінити, яку роль цей білок відіграє у розвитку різних пухлин.
В іншому дослідженні було помічено підвищену експресію CNPase в гострих клітинах мієлолейкозу HL-60 у присутності ретиноевої кислоти, агента, що застосовується в терапії цього типу раку [61]. Більше того, виявлено кореляцію зі зниженою експресією інших білків, що входять до складу мембран мітохондрій та регуляторів mPTP, VDAC та білка-транслокатора (TSPO) [61]. Повідомлялося, що TSPO збільшується при різних типах пухлин, включаючи пухлини мозку та гліоми [63,64,65]. Інші звіти вказують на ключову роль TSPO у розвитку ракових пухлин [63,66,67,68]. Спостережена кореляція між рівнями експресії mtCNPase та TSPO свідчить про загальний механізм канцерогенезу.
5.4. mtCNPase та гостра серцева недостатність
Оскільки мітохондрії є найважливішими органелами для нормального функціонування серця, порушення функціонального стану мітохондрій є частою причиною розвитку порушень серцево-судинної системи [71]. Виробництво АТФ, підтримання гомеостазу Са 2+ та проникність як внутрішньої, так і зовнішньої мембрани мітохондрій є найважливішими характеристиками функції мітохондрій; тому порушення в цих процесах можуть призвести до патологій. Таким чином, порушення метаболізму АТФ у мітохондріях, зумовлене змінами транспорту кальцію, спостерігається при метаболічних вадах серця. Спостерігалося зниження продукування АТФ та ретрактильного запасу в міокарді при метаболічних вадах серця [72]. Мітохондріальний Са 2+ також має важливе значення для виробництва АФК та функціонування mPTP. У процесах ішемії/реперфузії та серцевої недостатності ці фактори беруть участь [73,74,75].
Клітинна смерть після таких порушень внаслідок внутрішніх механізмів вбивства мітохондрій, некрозу та апоптозу лежить в основі безлічі серцевих захворювань [76]. Регулюючи проникність своїх мембран, мітохондрії контролюють некротичну та апоптотичну загибель клітин міокарда [77]. Таким чином, проникнення зовнішніх мембран білками сімейства Bcl-2 та регулювання проникності внутрішньої мембрани mPTP можуть розглядатися як центральні події при некрозі та апоптозі [77]. Роль mPTP у ряді серцево-судинних захворювань широко обговорювали [78,79,80,81,82]. Факти свідчать про те, що mPTP бере участь у кардіопротекторних сигнальних шляхах прямо чи опосередковано. Таким чином, mPTP став перспективною лікарською мішенню в терапевтичних підходах. Однак, незважаючи на багаторічні дослідження, складність процесу заважає дослідникам, а молекулярна ідентичність та механізм регуляції mPTP у серці досі незрозумілі.
Крім того, досліджували вплив астаксантину (AST) на параметри мітохондріальної функції. АСТ, як антиоксидант, має протизапальні властивості та потенціал як терапевтичний засіб при багатьох серцевих захворюваннях. AST - це каротиноїд ксантофілу, червоний пігмент, що надає морським тваринам, таким як лосось, форель, звичайні креветки та омари, своє відмітне червонуватий колір [92]. Є рослини, водорості та мікроорганізми, які містять високу концентрацію таких каротиноїдів, які є досить повсюдними. Люди не можуть їх синтезувати, і тому вони зобов’язані отримувати їх під час споживання їжі [93]. АСТ містить дві оксигеновані групи на двох кільцевих структурах, що визначає його посилені антиоксидантні здібності [94]. У моделі гомоцистеїнової кардіотоксичності АСТ зміг відновити цілісність мітохондрій та інгібувати опосередкований мітохондріями апоптоз [95,96]. Додавання AST запобігало розкриттю mPTP, а отже, покращувало функцію мітохондрій та зменшувало чутливість мітохондрій до стресу.
Було запропоновано, що mtCNPase виконує захисну функцію і може бути мішенню для ефекту AST при RHM. Ця гіпотеза буде перевірена в експериментах хронічного введення АСТ на щурах з гострою серцевою недостатністю в майбутньому. Тим не менше, AST можна розглядати як ефективний препарат для поліпшення серцевої функції в нормальних та патологічних умовах, і його молекулярною мішенню, здається, є mtCNPase. На малюнку 4 узагальнено роль mtCNPase у розвитку гострої серцевої недостатності.
- Активність 2 ′, 3′ ‐ циклічного нуклеотиду 3′ ‐ фосфодіестерази у тканинах щурів - Вейсбарт - 1982 -
- Кокон фосоріальної жаби Cyclorana australis функціонує насамперед як бар'єр для води
- Найкращі переваги та функції вправ для вправ для квадрицепсів
- Сила позитивних підтверджень може змінити ваше життя
- Зниження ваги та користь для серцево-судинної системи