Смертельна мієлосупресія, діарея та нейротоксичність, викликані поєднанням іринотекану та тегафуру-гімерацилу-отерацилу калію при лікуванні раку товстої кишки: випадок захворювання
Ян-Сі Лю 1 #, Ке-Цзя Ле 1 #, Чжи Чжан 1, Мін Цуй 1, Хун Чжоу 2, Ін-Цзе Су 1, Чжи-Чун Гу 1
# Ці автори зробили однаковий внесок у цю роботу.
Ключові слова: Побічна реакція на лікарські засоби (ADR); іринотекан; тегафур-гімерацил-отерацил калію (S-1); протокол справи; нейротоксичність
Подано 29 вересня 2019 р. Прийнято до публікації 15 листопада 2019 р.
Вступ
Хіміотерапія після лапароскопічної радикальної операції варіюється залежно від стадії новоутворення у хворих на рак товстої кишки. В даний час комбінована терапія іринотеканом S-1 показує ефективність метастатичного колоректального раку (mCRC) (1). Однак суттєві несприятливі ефекти, такі як шлунково-кишкова токсичність та гематологічна токсичність, знижують ефективність лікування. Тим часом підвищена стурбованість якістю життя хворих на рак також обмежує його використання.
Іринотекан, водорозчинний аналог камптотецину, був схвалений для лікування пацієнтів із розвиненою КРР шляхом інгібування ядерного ферменту топоізомерази I (2). Основними несприятливими ефектами іринотекану є діарея та нейтропенія. Повідомляється, що побічні ефекти залежали від дози при комбінуванні з фторурацилом/фоліновою кислотою (3). Фторпіримідин S-1 активний у широкому діапазоні солідних пухлин шляхом оборотного інгібування ферменту, що обмежує швидкість, у деградації 5-фторурацилу (5-FU) (4). В даний час у кількох статтях повідомляється про побічні явища S-1 та комбіновану терапію. Комбінована хіміотерапія з іринотеканом та S-1 схвалена для терапії mCRC другої лінії. Це повідомлення про тяжку мієлосупресію, діарею та нейротоксичність, спричинені комбінацією іринотекану та S-1.
Презентація справи
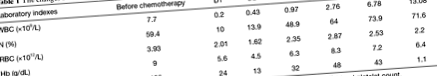
У 76-річної китайської жінки з одномісячною історією кровотечі в калі діагностували висхідний рак товстої кишки. Пацієнт отримав лапароскопічну радикальну операцію з приводу раку товстої кишки та був визначений як T3N0M0 за клінічними характеристиками та обстеженням клітинної патології. Пацієнтка добре одужала під час свого 11-денного перебування в лікарні. Через 15 днів після виписки вона повернулася до лікарні для хіміотерапії. Лабораторні дані щодо прийому до першої хіміотерапії представлені наступним чином: кількість лейкоцитів 7,7 × 10 9/л [довідка, (3,97–9,15) × 10 9/л]; нейтрофільні гранулоцити 59,4% (еталон, 50–70%); кількість еритроцитів 3,93 × 10 12/л [довідково, (3,68–5,13) × 10 9/л]; гемоглобін 119 г/дл (еталон, 113–151 г/дл); кількість тромбоцитів у крові 186 × 10 9/л [довідково, (101–320) × 10 9/л]. Фізичний огляд показав, що пацієнт має чітке свідомість та відсутність шлунково-кишкових відхилень, тим часом пацієнт не мав сімейного анамнезу і був психічно стабільним.
Пацієнтка отримувала схему хіміотерапії другої лінії, що складається з 240 мг іринотекану через вбудований порт для переливання вен та капсулу S-1 (80 м/добу, два рази на день, d1–14) для перорального прийому, оскільки вона мала алергію на оксаліплатин. Комбінована хіміотерапія повторюється кожні 21 день для кожного циклу. Протягом усього лікування хіміотерапією не було регулярного моніторингу рутинного обстеження крові, функції печінки та звичайного візуалізаційного обстеження.
Через три дні після 6-ї терапії (124 дні після першої хіміотерапії) пацієнт страждав на діарею, яка виникала 2–3 рази на день, супроводжуючись м’яким болем у животі, що не привертало уваги пацієнта. Протягом наступних чотирьох днів діарея поступово загострювалась і виникала 7–10 разів на день. Через дев'ять днів після останнього раунду хіміотерапії пацієнт виявив марення та незрозумілу свідомість, і він потрапив на екстрене лікування. Температура становила 38,6 ° C (референтна, 36,0–37,4 ° C), частота серцевих скорочень - 126 ударів в хвилину (контрольна, 60–100 ударів в хвилину), частота дихання - 26 в хвилину (контрольна, 16–20 в хвилину), а також кров тиск становив 105/65 мм рт.ст. (еталон, 90–140/60–90 мм рт. ст.). Лабораторні дані показали наступне: кількість лейкоцитів 0,20 × 10 9/л [довідково, (3,97–9,15) × 10 9/л]; нейтрофільний гранулоцит 10,0% (еталон, 50–70%); кількість еритроцитів 2,01 × 10 12/л (еталон, 3,68–5,13 × 10 12/л); гемоглобін 5,6 г/дл (еталон, 11,3–15,1 г/дл); кількість тромбоцитів у крові 24 × 10 9/л [довідково, (101–320) × 10 9/л].
Обговорення
Для пацієнтів з раком товстої кишки на стадії III або вище ад'ювантна хіміотерапія після операції є важливим способом покращення прогнозу. Хіміотерапія на основі 5-FU, хіміотерапія FOLFOX або CAPOX широко застосовуються як схеми хіміотерапії першої лінії колоректальної карциноми (6). Однак у пацієнта спостерігалася алергічна реакція на оксаліплатин, що розглядалося як схема хіміотерапії першого ряду. Іринотекан - інгібітор топоізомерази I, який виявляє ефективність як монотерапія при запущеному колоректальному раку (КРР) та є більш ефективним у поєднанні з фторурацилом. S-1 - це пероральний фторпіримідин, що включає три різні агенти: тегафур, гімерацил та отерацил. Деякі дослідження вказували, що комбінована терапія іринотеканом та S-1 може мати хорошу ефективність щодо mCRC, і кілька країн за межами США використовували комбіновану терапію як лікування другої лінії.
Мієлосупресія видається поширеною при комбінованій хіміотерапії. А діарею можуть спричиняти як іринотекан, так і S-1, навіть незважаючи на те, що гіпер-ентерит, пов’язаний з S-1, траплявся менше, ніж діарея, що викликається іринотеканом із затримкою. Хоча непритомність може бути спричинена дисбалансом водної електроліти, сироваткові електроліти були нормальними під час госпіталізації. Отже, нейротоксичність, пов’язану із одночасним введенням іринотекану та S-1, не може бути виключена відповідно до шкали ймовірності побічних реакцій на лікарські засоби Наранхо (певна> 8 балів, можливо 4–8 балів, можлива 1–4 бали, сумнівна 0 балів). Оцінка Наранхо пацієнта (шкала ймовірності несприятливої реакції на лікарські засоби), яка дорівнює 6, вказувала на те, що її діарея, що загрожує життю, мієлосупресія та нейротоксичність, ймовірно, були спричинені як іринотеканом, так і S-1 (Таблиця 3).
Що стосується нас, діарея та мієлосупресія, що загрожують життю, є токсичністю іринотекану, що обмежує дози, яка також може проявлятися при хіміотерапії S-1. Тому, як правило, під час хіміотерапії необхідний моніторинг показників крові та шлунково-кишкових побічних ефектів. Примітно, що цей пацієнт не виконував поради лікаря протягом 6 раундів комбінованої терапії іринотеканом та S-1. Як тільки сталася важка діарея та мієлосупресія, пацієнт був важко хворим. Хоча медики пришвидшили рятувальні роботи, пацієнт все-таки помер. Вперше повідомляється про нейротоксичність при комбінованій терапії іринотеканом та S-1.
Діарея та нейтропенія є основними обмежуючими дозу токсичністю монотерапії іринотеканом (7). Повідомлялося, що 80% пацієнтів, які застосовували іринотекан, мали діарею, і 30-40% з них були від 3 до 4 ступеня (2). Діарея, спричинена іринотеканом, має два типи: холінергічний синдром, який зазвичай виникає гостро під час або відразу після інфузії, інший - діарея з уповільненим початком з’являється приблизно через 5–6 днів після прийому кожні 3 тижні (8,9). Повідомляється про діарею, що загрожує життю, можливо, пов’язану з впливом гена SN-38 та UDP-глюкуроносилтрансферази 1A1 (10). Про діареї, пов’язані з S-1, повідомлялося менше, ніж про діареї, спричинені іринотеканом, але частота діареї, індукованої S-1, вище 3 ступеня все ще становила 34,5% під час лікування (11). У пацієнта з’явилася легка діарея після 6-го курсу лікування, а на 9-й день вона розвинулася до діареї 4 ступеня (стандарт CTCAE), що могло усунути ймовірність виникнення холінергічного синдрому. Але діарею, спричинену відстроченим початком, іринотекан та S-1 не можна виключити.
Мієлосупресія є найпоширенішим побічним ефектом усіх цитостатиків, який завжди призводить до відмови хіміотерапії. Постмаркетингове спостереження за 13 935 пацієнтами, які отримували іринотекан в Японії, повідомило про високу частоту мієлосупресії (ступінь 3 і більше) з лейкопенією 23,8% та 38,3%, тромбоцитопенією 6,5% та 14,3% для одинокого та одночасного застосування відповідно (12) . Частота захворювань крові та лімфатичної системи, пов’язаних із S-1, сягає 68,47%, причому ступінь тяжкості в більшості випадків становить ступінь I/II. Повідомляється, що ген DPYP може впливати на активність метаболічного ферменту 5-FU, що може сприяти різниці в концентрації S-1 у крові (13). Отже, пацієнти з меншою активністю ферментів на S-1 можуть страждати вищим ризиком мієлосупресії. Насправді мієлосупресія є передбачуваною при плановому дослідженні крові, і використання протимікробних препаратів, RHG-CSF та імунопотенціатора може допомогти запобігти зараженню та смерті. У цьому випадку пацієнт не послухався рекомендацій лікарів щодо регулярного контролю показника крові.
Як результат, пацієнт знаходився у критичному стані, коли були виявлені сильна нейтропенія та діарея (8). Нейротоксичність зазвичай повідомляється в схемах, що містять платину, і рідко трапляється при хіміотерапії, що стосується іринотекану або S-1. Незважаючи на це, нейротоксичність може бути наслідком водно-електролітного дисбалансу, спричиненого діареєю, порушенням функції печінки або нирок. Однак у пацієнта в цьому випадку спостерігався нормальний рівень функції нирок та метаболізм електролітів. Відповідно, можливість була великою, враховуючи, що нейротоксичність викликається хіміотерапією.
Висновки
Поєднання хіміотерапії з іринотеканом та S-1 може спричинити серйозні побічні ефекти, такі як мієлосупресія, діарея або навіть нейротоксичність. Тому для забезпечення безпеки та ефективності хіміотерапії важливо оцінити зміну біохімічних показників протягом курсу лікування. У разі серйозних побічних ефектів лікарі повинні негайно винести рішення та провести індивідуальне лікування. А самообслуговування та самоконтроль пацієнта також не враховується на ранній стадії несприятливих наслідків.
Подяка
Фінансування: Цей звіт про справу був підтриманий Фондами досліджень Шанхайської комісії з охорони здоров’я та планування сім’ї (20184Y0022), Фондом вирощування клінічних досліджень лікарні Рендзі (PY2018-III-06), Інститутом клінічних фармацевтичних інновацій Шанхайської школи університету Цзяо Тун Медицина (CXYJY2019ZD001, CXYJY2019QN004) та Програма ключових, але слабких дисциплін Шанхайської муніципальної комісії з питань охорони здоров'я та планування сім'ї (2016ZB0304).
Виноска
Конфлікт інтересів: Автори не мають заявляти про конфлікт інтересів.
Етична заява: Автори несуть відповідальність за всі аспекти роботи, забезпечуючи належне дослідження та вирішення питань, що стосуються точності або цілісності будь-якої частини роботи. Письмова інформована згода була отримана від родичів пацієнта на публікацію цього звіту про цей випадок.
- 1-річний хаскі з повторною діареєю
- Ліки проти діареї Безрецептурне полегшення діареї
- Повнотекстовий астаксантин, що не містить антиоксидантів, запобігає порушенню мітохондрій, спричиненому ізопротеренолом
- Детокс-напій ABC Чому яблуко, буряк та морква - чудове поєднання - їжа NDTV
- Гострий індукований гепатитом вторинний продукт для схуднення, придбаний через Інтернет