Кетогенна дієта з дуже низьким вмістом вуглеводів та еукалорієм при лікуванні акромегалії
До редактора:
Акромегалія зумовлена секрецією гормону росту пухлиною гіпофіза, і її ознаки пов’язують із підвищеним синтезом печінкового інсуліноподібного фактора росту (IGF-I), залежного від гормону росту. 1 Еукалорійна дієта з дуже низьким вмістом вуглеводів (2 і зменшення синтезу IGF-I. 3,4 Ліганди рецепторів соматостатину зменшують секрецію гіпофіза, що призводить до нормалізації IGF-I приблизно у 50% пацієнтів. 5 Ми припустили, що у пацієнтів при акромегалії еукалорійна кетогенна дієта з дуже низьким вмістом вуглеводів здійснювала б індуковану інсуліном нормалізацію IGF-I без небажаного збільшення гормону росту, враховуючи те, що терапія лігандами рецепторів соматостатину, що інгібують гормон росту, буде продовжена.
Ми провели дослідження, що підтверджує концепцію, в якому взяли участь 11 пацієнтів (6 з яких були жінками), щоб дослідити, чи діє 2-тижнева еукалорійна дієта з дуже низьким вмістом вуглеводів (35 г вуглеводів, приблизно 155 г жиру та приблизно 115 г білка на добу) як допоміжне лікування до лігандів рецепторів соматостатину першого покоління призведе до зниження концентрації IGF-I у пацієнтів з неконтрольованою акромегалією (номер судового реєстру Нідерландів, NL7093). Детальна інформація про проект дослідження наведена в протоколі, повний текст цього листа доступний на NEJM.org.
Фігура 1. 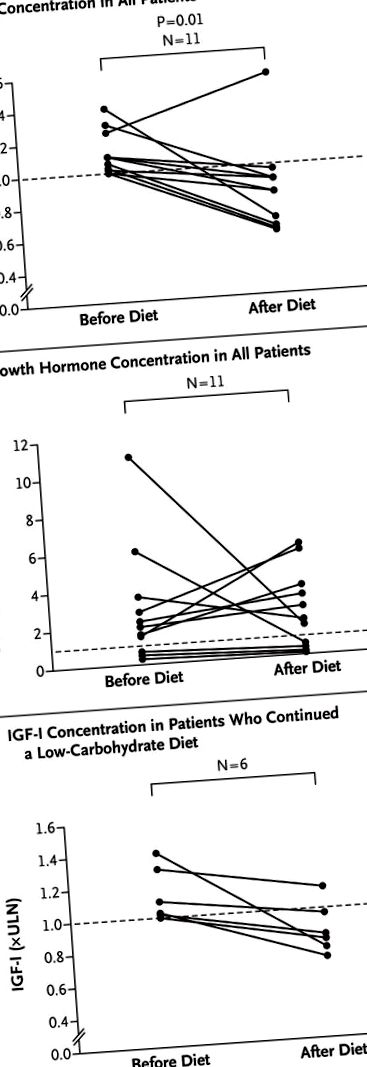
Усі пацієнти дотримувались евкалорійної дуже низьковуглеводної кетогенної дієти (35 г вуглеводів, приблизно 155 г жиру та приблизно 115 г білка на день) як допоміжний засіб до терапії лігандами рецепторів соматостатину першого покоління. На панелях A та B показано зміни концентрацій інсуліноподібного фактора росту I (IGF-I) та гормону росту відповідно у всіх 11 пацієнтів. На панелі С показано зміни в концентраціях IGF-I у 6 пацієнтів, які продовжували дієту з низьким вмістом вуглеводів (80 г вуглеводів на день) протягом медіани 3,0 місяця. Штриховою лінією на кожній панелі вказується нормальне значення. ULN позначає верхню межу норми.
Під час дієти середнє (± SD) споживання вуглеводів у пацієнтів зменшилось із 194,4 ± 143,1 г на день до 32,6 ± 14,7 г на день. Медіана концентрації IGF-I значно зменшилася - з 1,10 рази верхньої межі норми (інтерквартильний діапазон, 1,02-1,25) до 0,83 рази верхньої межі норми (міжквартильний діапазон, 0,62-0,91) (Р = 0,01) і нормалізується у всіх пацієнтів, крім одного (рис. 1А). Не спостерігалось супутнього підвищення концентрації гормону росту (медіана, 2,0 мкг на літр [інтерквартильний діапазон, 0,7-3,6] до дієти проти 1,9 мкг на літр [інтерквартильний діапазон, 0,4-3,7] після дієти; Р = 1,00 ) (Малюнок 1B). У одного пацієнта, у якого після дієти не було нормальної концентрації IGF-I, суттєво знизилася концентрація гормону росту і він мав найвищий ступінь резистентності до інсуліну. Загалом рівень глікованого гемоглобіну дещо знизився (з 39,8 ± 5,2 до 38,6 ± 4,4 ммоль на моль; середня різниця - 1,2 ммоль на моль; 95% довірчий інтервал - від 2,1 до –0,3). Хоча дієта була еукалорійною, середня вага тіла зменшилась приблизно на 1 кг. Асоціація втрати ваги та зміни концентрацій IGF-I не була суттєвою (коефіцієнт Спірмена, -0,24).
В цілому дієта була прийнята добре; всі пацієнти завершили дослідження. Зниження дози ліганду рецептора соматостатину було можливим у трьох із шести пацієнтів, які продовжували дотримуватися кетогенної дієти з низьким вмістом вуглеводів (80 г вуглеводів на день) як допоміжне лікування до початкової терапії лігандом рецептора соматостатину. Через медіану 3,0 місяця середня концентрація IGF-I серед цих пацієнтів становила 0,83 рази верхню межу норми (інтерквартильний діапазон, 0,75-1,01) (рис. 1С).
Хоча жоден з учасників не мав діабету 2 типу та побічних явищ, пов'язаних з гіпоглікемією, ми рекомендуємо жорсткий контроль глікемії у пацієнтів, які приймають протидіабетичні препарати. Первинна профілактика зневоднення, поширений побічний ефект, може бути забезпечена достатнім споживанням рідини (≥2 літри на день).
Наше пілотне дослідження показало здатність ад'ювантної евкалорійної дієти з дуже низьким вмістом вуглеводів кетогенної дієти приводити до контролю IGF-I у пацієнтів з акромегалією, захворювання якої не контролювалось терапією лігандом рецепторів соматостатину першого покоління. Потрібні додаткові дослідження, щоб оцінити довгострокову безпеку та ефективність евкалоричної кетогенної дієти з дуже низьким вмістом вуглеводів.
Єва К. Купманс, доктор медичних наук.
Кірстен А.К.Берк, к.т.н.
Нур Ель-Саєд, доктор біологічних наук.
Себастьян Дж. Неггерс, доктор медичних наук, доктор філософії.
Аарт Дж. Ван дер Лелі, доктор медичних наук, доктор філософії.
Медичний центр університету імені Еразма, Роттердам, Нідерланди
[електронна пошта захищена]
Форми розкриття інформації, надані авторами, доступні з повним текстом цього листа на NEJM.org.
1. Melmed S. Патогенез акромегалії та лікування. J Clin Invest 2009; 119: 3189 - 3202 .
2. Leung K-C, Doyle N, Ballesteros M, Waters MJ, Ho KKY. Інсулінова регуляція рецепторів печінкового гормону росту людини: дивергентний вплив на біосинтез та поверхневу транслокацію. J Clin Endocrinol Metab 2000; 85: 4712 - 4720 .
3. Клеммонс ДР. Залучення інсуліноподібного фактора росту-I до контролю гомеостазу глюкози. Curr Opin Pharmacol 2006; 6: 620 - 625 .
4. Хо PJ, Friberg RD, Barkan AL. Регулювання пульсуючої секреції гормону росту шляхом голодування у нормальних пацієнтів та пацієнтів з акромегалією. J Clin Endocrinol Metab 1992; 75: 812 - 819 .
5. Кармайкл Дж. Д., Бонерт В. С., Нуньо М, Лі Д, Мелмед С. Вплив методології клінічного випробування на акромегалію на зареєстровані показники біохімічної ефективності лікування лігандами рецепторів соматостатину: мета-аналіз. J Clin Endocrinol Metab 2014; 99: 1825 - 1833 .
- Вплив кетогенної дієти на силу та силу
- Ефекти періодичної нежирної, низькокалорійної дієти при поведінковому лікуванні ожиріння -
- Вплив кетогенної дієти під час вагітності на ембріональний ріст миші - PubMed
- Вплив втрати ваги від дієти з дуже низьким вмістом вуглеводів на функцію ендотелію та маркери
- Зниження когнітивних здібностей може бути дієтою як профілактичний засіб або варіант лікування