Екстракт щитовидної залози
Пов’язані терміни:
- Левотироксин
- Ліотиронін
- Гормон щитовидної залози
- Тиреоглобулін
- Хвороба щитовидної залози
- Визначення гормону
- Тиреоїдит
- Гіпотиреоз
- Тиреотропін
Завантажити у форматі PDF
Про цю сторінку
Том II
Екстракт щитовидної залози тварин
Висушений екстракт щитовидної залози (ДТЕ), хоча і ефективний, більше не рекомендується керівними принципами з огляду на широку доступність синтетичного левотироксину. 118 Після прийому висушеної щитовидної залози може спостерігатися злегка підвищений рівень Т3 у сироватці крові, пов’язаний із тимчасовими тиреотоксичними симптомами, такими як серцебиття; цього не спостерігається після левотироксину. Нещодавнє дослідження, в якому порівнювали DTE (щитовидна залоза броні, кожне зерно 65 мг, що містить 38 мкг L-T4 та 9 мкг L-T3) та левотироксин, повідомляло про помірну втрату ваги та більшу перевагу пацієнтів щодо DTE перед левотироксином; рівень Т3 у сироватці крові був вищим, а рівень ФТ4 був нижчим під час ДТЕ, ніж під час лікування левотироксином. 153 Деякі пацієнти віддають перевагу використанню знежиреної щитовидної залози, і це може бути прийнятним, якщо рівень ТТГ є нормальним.
Використання ретиноїдів для збільшення поглинання радіойоду при раку щитовидної залози
Венді Елла, Сьюзен Шорт, у Всебічному довіднику йоду, 2009
Поглинання йоду клітинами щитовидної залози
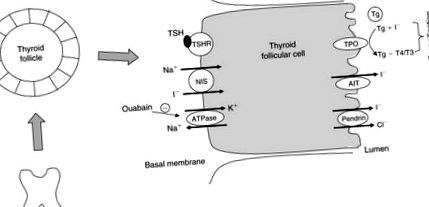
Щитовидна залоза витягує йод із кровообігу і містить до 90% загального йоду в організмі. Накопичення йоду з кровотоку в фолікулах щитовидної залози здійснюється за допомогою трансмембранної молекули-транспортера, яка називається симпортером йодиду натрію (NIS) (Dai et al., 1996). Це глікопротеїн, зв’язаний з мембраною, з 13 трансмембранними доменами і експресується на базолатеральній мембрані фолікулярних клітин щитовидної залози.
У нормальній щитовидній залозі NIS транспортує два Na + та один I - вниз за градієнтом іонів Na +, що утворюється внаслідок активності Na +/K + ферменту аденозинтрифосфатази (АТФаза) (рис. 102.2). Якщо АТФаза блокується уабаїном, поглинання йоду щитовидною залозою також блокується.
Малюнок 102.2. Молекули, що беруть участь в йодиді (I -), транспортуються через клітину фолікула щитовидної залози. ТТГ, тиреотропний гормон; TSHR, рецептор TSH; NIS, симпортер йодистого натрію; TPO, фермент пероксидази щитовидної залози; AIT, апікальний йодистий транспортер; Tg, тиреоглобулін.
Йодид в апікальних клітинах виділяється в фолікулярний просвіт через апікальний йодистий транспортер (Rodriguez et al., 2002) та пендрин, продукт гена синдрому Педенса (Royaux et al., 2000; Yoshida et al., 2004). Потім йод переноситься на тиреоглобулін (Tg), який знаходиться на апікальній мембрані поза фолікулярними клітинами, і зазнає йодування внутрішніх залишків тирозину, каталізованих пероксидазами щитовидної залози (ТПО). ТТГ підвищує експресію генів, пов'язаних з обробкою синтезу йодидів та гормонів у щитовидній залозі, включаючи NIS, Tg та TPO (Dunn and Dunn, 2001).
Лікування диференційованого раку щитовидної залози радіойодом залежить від здатності злоякісних клітин накопичувати йод так само, як і нормальні клітини епітелію щитовидної залози.
Радіойодид доставляється у вигляді перорального препарату і всмоктується із шлунку та тонкої кишки. Потім він концентрується в тканинах через функцію NIS і поєднується з Tg, продовжуючи біологічний період напіввиведення радіойоду. Високоенергетичні ізотопи з довгим періодом напіввиведення, такі як I-131, використовуються терапевтично для руйнування тканини щитовидної залози як при гіпертиреозі, так і при метастатичному раку щитовидної залози після тиреоїдектомії.
Лікування радіойодом може знищити приховану мікрокарциному і зменшити швидкість прогресування метастатичної пухлини (Hershman et al., 1995; Schlumberger, 1998). Очевидно, що ефективність лікування радіойодом залежить від максимального поглинання радіойоду та продовження періоду його збереження в тканині щитовидної залози.
Поглинання йоду після стимуляції ТТГ достатньо для більшості диференційованих видів раку щитовидної залози, щоб використовувати β-випромінюючий радіоактивний йод для лікування залишкових та метастатичних захворювань. Підвищений рівень ТТГ у сироватці крові (що може бути досягнуто шляхом відміни гормону щитовидної залози після тиреоїдектомії або введення рекомбінантного ТТГ людини) безпосередньо стимулює експресію гена NIS та транспорт і введення NIS у плазматичну мембрану, збільшуючи поглинання радіойоду. Більше 70% диференційованих видів раку щитовидної залози концентрують радіойод після стимуляції ТТГ. Решта 10–20% диференційованих видів раку щитовидної залози не експресують NIS, незважаючи на стимуляцію ТТГ, що пов’язано з поганим прогнозом (Robbins et al., 1991; Schmutzler and Koehrle, 2000).
Експресія NIS при пухлинах щитовидної залози корелює з їх здатністю концентрувати радіойод. Шмуцлер та ін. (1997) повідомили, що регульована експресія гена NIS призвела до резистентності до терапії I-131, оскільки це зменшило поглинання йодиду в клітинах раку щитовидної залози. Регуляція експресії NIS у нормальних та злоякісних клітинах щитовидної залози була широко досліджена, і визнано, що різні агенти впливають на експресію.
NIS щурів та людини був клонований та охарактеризований у 1996 р. Одним із підходів до підвищення експресії NIS є передача генів. Багато досліджень досліджували вплив переносу NIS на терапію радіойодом (Lee et al., 2004; Spitzweg et al., 2003), і було показано, що трансфекція NIS вірусним вектором індукує поглинання йодиду в кількох клітинних лініях нетиреоїдної пухлини людини та ксенотрансплантати, включаючи гліоми, рак передміхурової залози, рак яєчників та рак товстої кишки (Mandell et al., 1999; Cho et al., 2000).
Альтернативний підхід, досліджений в останніх дослідженнях, полягає у стимулюванні експресії NIS при агресивному раку щитовидної залози шляхом введення редиференціаційних засобів, включаючи ліганди ядерних рецепторів та інгібітори епігенетичних модифікацій. Для стимулювання експресії НІС як в моделях in vitro, так і in vivo використовували широкий спектр агентів для диференціації, а деякі використовували в клінічних дослідженнях. Ретиноїди є однією з таких груп редиференціаційних засобів, які були широко досліджені.
Гормони щитовидної залози
Кійосі Ямаучі, у Довіднику про гормони, 2016
Історія
У 1895 р. Адольф Магнус-Леві встановив, що годування пацієнтами екстрактом щитовидної залози підвищує швидкість метаболізму [1]. Активна сполука була виділена із щитовидної залози Едвардом Келвіном Кендаллом у 1914 р. І отримала назву тироксин (Т4) [2]. Т4 був синтезований в 1927 р. Пізніше з плазми було виділено 3,3 ′ 5-трийодтироніну (Т3), який є фізіологічно активнішим за Т4. У 1966 р. Було встановлено, що Т3 стимулює ДНК-залежну активність РНК-полімерази. КДНК ядерних рецепторів гормонів щитовидної залози (TR) були клоновані в 1986 р. Тиронаміни, декарбоксильовані та дейодировані метаболіти гормонів щитовидної залози (THs), були показані потенційними лігандами для рецептора 1, пов'язаного з мікроаміноцитами, (нового класу білка G) -парні рецептори (GPCR), у 2004 р. [3]. У 2005 р. Було виявлено, що рецептор плазматичної мембрани для THs знаходиться на інтегрині αvβ3 [4] .
Гіпотиреоз
Заміна висушеної свинячої щитовидної залози
Свинячий гормон щитовидної залози (наприклад, Armor, Nature-Throid, Westhroid) - це старший препарат, що застосовується при гіпотиреозі, і який вважається застарілим, а іншим - настільки ж ефективним або перевершує синтетичні гормони. Висушена свиняча щитовидна залоза містить приблизно 20% Т3 і 80% Т4, а також інші йодовані сполуки, дійодтирозин (Т2) та монойодтирозин (Т1), які можуть зіграти певну роль у наданні додаткового полегшення симптомів. Як і у випадку з синтетичними аналогами Т4 та Т3, ретельний контроль за симптомами та режим тестів на функцію щитовидної залози є важливими при догляді за пацієнтом, якому призначили свинячу заміну щитовидної залози. Рекомендовані дози гормонів щитовидної залози наведені в таблиці 33-4. 2, 55, 56, 58, 59
1 зерно (60 мг) свинячої щитовидної залози = 100 мкг тироксину (Т4) і 25 мкг трийодтироніну (Т3).
- Передача навчання - огляд тем ScienceDirect
- Термогравіметричний аналіз - огляд тем ScienceDirect
- Йохімбін - огляд тем ScienceDirect
- Концентрат сироваткового протеїну - огляд тем ScienceDirect
- Вудлоуз - огляд тем ScienceDirect