Вплив та зниження ваги на фактори серцево-судинного ризику у чоловіків із надмірною вагою
Кафедра біомедичних наук факультету охорони здоров'я та медичних наук Університету Копенгагена, Копенгаген, Данія
Адреса для запитів на передрук та іншої кореспонденції: М. Розенкільде, департамент біомедичних наук, ун-т. Копенгагена, Блегдамсвей 3, 2200 Копенгаген N, Данія (електронна пошта: [електронна пошта захищена]).
Кафедра біомедичних наук факультету охорони здоров'я та медичних наук Університету Копенгагена, Копенгаген, Данія
Кафедра біомедичних наук факультету охорони здоров'я та медичних наук Університету Копенгагена, Копенгаген, Данія
Кафедра біомедичних наук факультету охорони здоров'я та медичних наук Університету Копенгагена, Копенгаген, Данія
Кафедра клінічної медицини факультету охорони здоров'я та медичних наук Університету Копенгагена, Копенгаген, Данія
Rigshospitalet, Копенгаген, Данія
Кафедра біомедичних наук факультету охорони здоров'я та медичних наук Університету Копенгагена, Копенгаген, Данія
Анотація
Рис. 1.Потік учасників. С, контроль; D, дієта; Т, навчання; T-iD, дієта з підвищеним тренуванням.
Зразки крові.
Артеріалізовані зразки крові збирали в крижані пробірки і негайно центрифугували (4000 об/хв при 4 ° C протягом 10 хв), а плазму виділяли і зберігали при -80 ° C до аналізу. У пробірках для вимірювання TC, LDL-C, HDL-C, apoA1, apoB і TG містився гепарин (10 мкл/мл), а в трубках для вимірювання окислення до β-HDL та LDL-C містився EDTA (10%, 15 мкл/мл).
Ліпіди та ліпопротеїни плазми.
Ніякого додавання інгібіторів LCAT та жодної іншої попередньої обробки не проводили. TC, LDL-C, HDL-C та TG у плазмі крові досліджувались ферментативно (Cobas; Roche Diagnostics, Мангейм, Німеччина). apoA1 та apoB аналізували за допомогою імунотурбідиметричної процедури, визначеної модулем Roche Modular Analytics (SWA) Modul P (Roche Diagnostics) відповідно до технічних вимог виробника та з використанням відповідних реагентів.
Для виділення ліпопротеїнів 1 мл плазми піддавали ультрацентрифугуванню для отримання VLDL-C (d 2+ і вимірюється за допомогою моніторингу утворення кон'югованих дієнів. Кінетику окислення LDL-C визначали, контролюючи зміну поглинання. Сто п'ятдесят мікролітрів LDL-C (100 мкг/мл) поміщали в 96-лункову мікропланшет (Costar UV-Transparent Microplates; A. Daigger, Vernon Hills, IL), і окислення ініціювали додаванням 16,7 мкл CuSo4 (25 мкмоль/л). Абсорбцію кожної лунки постійно контролювали при 234 нм з інтервалом 2,5 хв протягом 10 год при 26 ° C, використовуючи планшетний зчитувач із програмним забезпеченням KC 4 (Bio-Tek Instruments, Копенгаген, Данія). Всі зразки проводили з подвійним визначенням, і зразки від кожного суб'єкта проводили в одному і тому ж аналізі.
Профіль поглинання та часу був розділений на три фази, фазу затримки, фазу розповсюдження та фазу розкладання (10), а окислюваність LDL-C описується різними параметрами профілю. Максимальна кількість кон'югованих дієнів, що утворюються в LDL-C, оцінювали як максимальне значення поглинання (10). Максимальна швидкість окислення була розрахована як нахил кривої під час фази лінійного поширення. Час відставання оцінювали, проводячи перпендикулярну пряму до х-осі від перетину двох прямих ліній, проведених крізь фази відставання та поширення кривої поглинання (9). CV між подвійними визначеннями становили 3,8, 4,3, 2,4 за час затримки, максимальну швидкість окислення та максимальну абсорбцію відповідно.
Попередньо β-ЛПВЩ.
Кількість попереднього β-HDL визначали у фракціях HDL-C шляхом схрещеного імуноелектрофорезу (31). У першому вимірі електрофорезу були розділені ліпопротеїни з α- та β-рухливістю. Електрофорез проводили в 1% (мас./Об.) Агарозному гелі (Agarose HSA Litex, Glostrup, Данія), розміром 10 × 20 см, у барбітальному буфері (рН 8,6; Регіон Hovedstadens Apotek, Herlev, Данія). Плазму розбавляли H2O у 10 разів і застосовували при 7,5 мкл/лунку. Перший розмір тривав 5,5 см протягом 45 хв при 300 В. Доріжка ліпопротеїдів у першому гелі була розрізана на шматочки по 1 см і переміщена в плівку GelBond (Cambrex, East Rutherford, NJ), розміром 10 × 10 см. Шістдесят мілілітрів 1% агарозного гелю змішували при максимумі 56 ° C з 250 мкл поліклонального кролячого анти-людини apoA1 (Dako, Glostrup, Данія). Смужку гелю відпалювали розплавленим агарозним гелем, що містить антитіло. Електрофорез другого виміру проводили до рівноваги при 4 ° С при 80 В у барбітальному буфері (рН 8,6). Виділені ліпопротеїнові антигени з першого агарозного гелю мігрували у другий агарозний гель і осаджувались антитілом. Гель промивали H2O і пресували, а комплекси апоА1-імуноглобуліну фарбували блискучим синім кумасі (5%, область Hovedstadens Apotek) перед сушінням.
Всі зразки були проведені в двох примірниках. Зразки до та після втручання з кожного суб'єкта проводили одночасно. CV між подвійними визначеннями становив 19,0% для пре-β-HDL. Засліплені для втручання, ділянки під кривими імунопреципітації вимірювали тричі після фарбування за допомогою програмного забезпечення Leica IM50 Image Manager (Leica Microsystems, Wetzlar, Німеччина). Середнє значення CV для потрійних вимірювань становило 3,4%. CV для α-піків становив 0,8%, а CV для pre-β піків - 6,2%. Області до β-ЛПВЩ виражаються у відсотках від суми апоА1, присутніх у зонах до β-ЛПВЩ та α-ЛПВЩ. Концентрації пре-β-ЛПВЩ також вказані в абсолютних кількостях (грами апоА1, присутніх у частинках пре-β-ЛПВЩ на літр плазми), розраховані як г/л.
Статистичний аналіз.
Описові дані до і після втручання описуються як засоби ± SD. Відмінності в групах описуються як засоби із двосторонніми 95% довірчими інтервалами (ДІ) та між групами як скориговані середньоквадратичні середні значення з двосторонніми 95% ДІ. Зміни всередині групи оцінювались за допомогою пар т-тесту та для оцінки основних ефектів втручання оцінювали відмінності між групами, використовуючи аналіз коваріації зі значеннями постінтервенції як залежних змінних та вихідних значень та присвоєння групі як коваріати. Усі попарні порівняння коригували за допомогою процедури Тукі. Зв'язок між базовими показниками та оцінками змін оцінювали за допомогою кореляційного аналізу Пірсона. Неналагоджений субаналіз був проведений за допомогою непарного т-тест для порівняння змін ТК, ЛПНЩ, ХС ЛПВЩ і ТГ протягом втручання для осіб із концентрацією дисліпідемії та нормоліпідемії на початковому рівні (22). Рівень значущості був обраний як P -1 кг · -1 збільшився як наслідок тренування як в Т, так і в Т-іД порівняно з С (P
Таблиця 1. Базові характеристики
Усі дані виражаються як середні значення ± SD; n = 12. апоА1, аполіпопротеїн А1; апоВ, аполіпопротеїн В; С, контрольна група; D, дієтична група; HDL-C, холестерин ліпопротеїдів високої щільності; LDL-C, холестерин ліпопротеїдів низької щільності; Т, навчальна група; T-iD, група дієти з підвищеним тренуванням; ТГ, тригліцериди; ЛПНЩ-С, холестерин ліпопротеїдів дуже низької щільності; V̇ o 2пік, пікове споживання кисню.
* Розраховано з г/л (11).
Таблиця 2. Зміни у складі тіла та аеробній формі
Дані є середніми ± SD, а рівень значущості - P † Значно відрізняється від С;
§ суттєво відрізняється від D;
‡ суттєво відрізняється від T-iD.
Таблиця 3. Відповідність тренувань та дієтичне споживання
Дані є середніми ± SD, а рівень значущості - P † Значно відрізняється від С;
‡ Значно відрізняється від T-iD.
Ліпіди та ліпопротеїни плазми.
Відповідно до встановлених рекомендацій щодо гіперхолестеринемії (22), 10 із 48 учасників мали граничний підвищений рівень ТК (> 5,0 ммоль/л) на початку, 18 учасників мали підвищений рівень ЛПНЩ (> 3,0 ммоль/л), 27 учасників знизили рівень ЛПВЩ (1,7 ммоль/л). На початковому рівні (n = 48 для всіх аналізів), ЛПВЩ-C, як очікувалося, позитивно пов'язаний з апоА1 (р 2 = 0,89, P 2 = −0,59, P 2 = -0,64, P 2 = −0,29, P = 0,04). Аналогічно, LDL-C позитивно асоціювався з apoB (р 2 = 0,87, P 2 = 0,92, P 0,17), хоча спостерігалася тенденція до зменшення в межах D (TC: P = 0,054; LDL-C: P = 0,074; Рис.2, A і B). HDL-C (P > 0,1 для всіх порівнянь; Рис.2C.) і TG (P > 0,6 для всіх порівнянь; Рис.2D) втручання не впливали, але при T-iD ЛПВЩ підвищувався від вихідного рівня в межах групи [0,15 ммоль/л (0,10; 0,21), P 0,25 для обох; дані не відображаються). Обидві зміни ТК та ХС ЛПНЩ були пов'язані зі зміною маси тіла (ТК: р 2 = 0,44, P 2 = 0,42, P 2 = 0,46, P 2 = 0,43, P 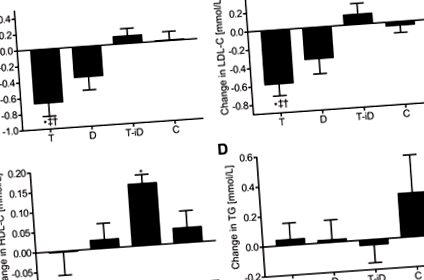
Рис.2.Зміни загального холестерину (ТК; A), холестерин ліпопротеїдів низької щільності (ЛПНЩ; B), холестерин ліпопротеїдів високої щільності (ЛПВЩ; C.) та тригліцериди (TG; D) після 12 тижнів тренувань на витривалість (T), дієти зі зниженою енергією (D), тренувань на витривалість з дієтою з підвищеною енергією (T-iD) або продовження сидячого життя (C). Дані представлені у вигляді засобів із 95% довірчими інтервалами; n = 12 у кожній групі. † Значно відрізняється від С; ‡ суттєво відрізняється від T-iD; * значна різниця в групі (до втручання). P
Подібно до змін рівня ХС ЛПНЩ, ApoB був знижений у T в порівнянні з обома T-iD [-0,6 мкмоль/л (-1,1, -1,1), P 2 = 0,85, P 0,14), хоча з'явилася різниця між T та T-iD (P = 0,08), а апоА1 було збільшено в межах T-iD (P
Рис.3.Зміни в аполіпопротеїні В (апоВ; A), аполіпопротеїн А1 (апоА1; B), а також співвідношення apoB/apoA1 (C.) після 12 тижнів тренувань на витривалість (T), дієти зі зниженою енергією (D), тренувань на витривалість з дієтою з підвищеною енергією (T-iD) або тривалого сидячого життя (C). Дані представлені у вигляді засобів із 95% довірчими інтервалами; n = 12 у кожній групі. † Значно відрізняється від С; ‡ суттєво відрізняється від T-iD; * значна різниця в групі (до втручання). P
Були ознаки ремоделювання ЛПВЩ в Т, оскільки загальна кількість пре-β-ЛПВЩ мала тенденцію до зменшення порівняно з обома Т-іД [-0,017 г/л (-0,036, 0,001), P = 0,07; Рис.4A] і C [-0,018 г/л (-0,036, 0,001), P = 0,06]. Крім того, відносна кількість пре-β-ЛПВЩ до apoA1 мала тенденцію до зниження Т в порівнянні з С [-1,3% (-2,6, 0,01), P = 0,05; дані не відображаються]. Схильність ЛПНЩ до окислення залишається незмінною, як вимірюється часом затримки окислення ЛПНЩ (P > 0,51 для всіх порівнянь; Рис.4B), а також максимальна швидкість окислення LDL-C не була змінена в жодній з груп втручання (P > 0,11 для всіх порівнянь; дані не відображаються).
Рис.4.Зміни ліпопротеїдів до β-високої щільності (пре-β-ЛПВЩ; A) і окислення ЛПНЩ (B) після 12 тижнів тренувань на витривалість (T), дієти зі зниженою енергією (D), тренувань на витривалість з дієтою з підвищеною енергією (T-iD) або продовження сидячого життя (C). Дані представлені у вигляді засобів із 95% довірчими інтервалами; n = 12 у кожній групі.
Як фізичні вправи, так і зниження ваги є стратегією способу життя, яка зменшує серцево-судинний ризик у людей із зайвою вагою, але їх відносний вплив та механістична основа не ясні. У цьому дослідженні ми досліджували незалежні та комбіновані ефекти фізичних вправ та зниження ваги, пов’язаного з дієтою, на фактори ризику серцево-судинної системи у групі чоловіків із неповноцінною сидячою вагою; особи, яким загрожує серцево-судинне захворювання. Первинним висновком у цьому рандомізованому контрольованому дослідженні було те, що індукована фізичними вправами втрата ваги мала найвидатніший вплив на серцево-судинний ризик, що визначається зниженням рівня ТК, ЛПНЩ і апоВ, тоді як зниження ваги, спричинене дієтою, не дало значних ефектів . Крім того, ми виявили, що HDL-C та apoA1 збільшуються лише після фізичних вправ із збільшеним споживанням їжі (отже, без втрати ваги), що свідчить про те, що такі корисні зміни потребують нейтрального енергетичного балансу.
Механізми кардіопротекторного ефекту фізичних вправ інтригують, а патогенез раннього атеросклерозу є багатофакторним процесом (26), в якому накопичення певних проатерогенних ліпопротеїнів відіграє вирішальну роль у місцях передлезіональної терапії. Раннім фактором є посилене утримання багатих на апоВ ліпопротеїдів у чутливих ділянках (36), а отже, знижена концентрація циркулюючого апоВ в Т представляє інтерес. Крім того, співвідношення apoB/apoA1 вважається чутливим предиктором гострого інфаркту міокарда (17, 32), і зменшення цього співвідношення в T підкреслює клінічну значимість фізичних вправ.
В останні роки фокус на ЛПВЩ перейшов від простої кількості до якості ЛПВЩ (23). Незважаючи на те, що ми не вимірювали здатність витікання ЛПВЩ, нинішні дані демонструють тенденцію до зменшення плазмового пре-β-ЛПВЩ шляхом тренувань. Отже, на взаємоперетворення між підвидами частинок ЛПВЩ-ЛПВЩ і як таке на якість пулу плазмових частинок ЛПВЩ-С може справді вплинути тренування.
Хоча і не зовсім добре охарактеризовано, схильність ЛПНЩ до окислення може бути вирішальним етапом у процесі серцево-судинних захворювань (20). Ми виміряли сприйнятливість до окислення в ізольованому LDL-C, але не виявили індивідуальних або комбінованих наслідків фізичних вправ та втрати ваги. Однак наші учасники були відносно здоровими на одне включення, оскільки лише 18 із 48 учасників демонстрували підвищені концентрації ЛПНЩ на вихідному рівні, і це може пояснити відсутність поліпшення. Навіть на моделях на тваринах певний поріг концентрації ЛПНЩ повинен бути перевищений для атерогенезу (4). Те, як фактори способу життя впливають на схильність ХС ЛПНЩ до окислення, заслуговує на подальше дослідження у континуумі серцево-судинних захворювань.
Сильними сторонами нашого дослідження є рандомізований, контрольований дизайн та ретельний контроль, який ми здійснювали за різними втручаннями, залишаючи дослідження високим рівнем завершення та чудовою відповідністю дослідженню (18). Через величину вибірки учасників ми не маємо статистичної сили описувати потенційний адитивний ефект фізичних вправ та втрати ваги на дисліпідемію, і це обмежує інтерпретацію даних. Статеві відмінності добре відомі в метаболізмі ліпідів та ліпопротеїнів (33), і обмеження нашого дослідження полягає в тому, що ми включали лише чоловіків.
- Вплив глікемічного навантаження на втрату ваги у дорослих із зайвою вагою Американський клінічний журнал
- Вправа для схуднення Американський журнал клінічного харчування Oxford Academic
- Хороша рада вправ, яка допоможе схудненню
- Складаний фітнес-вправа Батут-ребаундер DJXLMN Верхній відбій Кардіо Втрата ваги для приміщень
- Чи впливає надмірна вага на родючість у чоловіків, які втрачають вагу