Чому в Японії висока частота раку шлунка? Порівняння гастриту між пацієнтами з Великобританії та Японії
Анотація
Передумови та цілі
Частота раку шлунка в Японії в чотири рази вища, ніж у Великобританії. Зазвичай він виникає у шлунку з переважним тілом або пангастриті, який зазнав великої атрофії та метаплазії кишечника. Ми висунули гіпотезу, що у населення Японії буде важчий гастрит із переважним тілом або пангастритом та більшим ступенем атрофії та метаплазії кишечника, ніж у Великобританії. Щоб перевірити це, ми розробили порівняльний тест.
Методи
Всього до служб ендоскопії у Лідсі та Токіо було набрано 252 послідовних пацієнтів, які відповідали віку. У кожному центрі з кожного десятиліття у віці від 20 до 80 років проспективно відбирали 21 пацієнта. У всіх переважаючим симптомом був епігастральний дискомфорт. Хворі на виразкову хворобу, рак та езофагіт були виключені. П’ять шлункових біопсій були обстежені двома гістопатологами з використанням оновленої Сіднейської системи. Інфекцію хелікобактер пілорі оцінювали за гістологією та культурою біопсій та імуноферментним аналізом та імуноблотом плазми крові.
Результати
Обидва патологи виявили гастрит у 59 (47%) Великобританії та 76 (60%) японських пацієнтів (тест χ 2, р = 0,04). У тих пацієнтів з гастритом переважне тіло або пангастрит було поширеним серед японців (63% Японії проти 36% у Великобританії (тест χ 2, p = 0,003) Атрофія та метаплазія кишечника були більш масштабними та важкими (тест Манна-Уітні, тест p 2, p = 1) Пацієнти з японським гастритом виявили позитивний результат на H. pylori. Використовуючи раніше описаний "індекс ризику раку шлунка" серед пацієнтів з позитивним ураженням H pylori, було значно більше японців, ніж британських, з оцінкою "високого ризику".
Висновок
У японців, на відміну від англійських пацієнтів, гастрит є більш поширеним і важким, з більшою частиною тіла, що переважає атрофією та кишковою метаплазією. Ці відмінності можуть частково пояснити більшу частоту раку шлунка в Японії.
Захворюваність на рак шлунка різниться у різних країнах світу. Це в чотири рази частіше в Японії, ніж у Великобританії, і трапляється в молодшому віці. 1 Різні етіологічні фактори були висунуті для врахування цих відмінностей, включаючи поширеність Helicobacter pylori 2 та вірулентність 3, а також дієтичні 4 та генетичні 5 варіації між різними популяціями.
Гіпотеза Корреа постулює прогресування від хронічного гастриту до атрофії шлунка та метаплазії кишечника (ІМ), що призводить до дисплазії та, нарешті, раку. 6 Гістологічно рак шлунка класифікується як “кишковий” або “дифузний”. Рак кишечника є загальним явищем і пов’язаний з атрофією та ІМ, тоді як дифузний рак має тенденцію виникати в зонах активного запалення. Обидва вони тісно пов’язані з інфекцією H pylori. Отже, тяжкість та гістологічний вигляд гастриту є важливими, але характер гастриту здається ще більш важливим. У пацієнтів з переважаючим тілом або пангастритом (гастрит, що вражає тіло більше, ніж антральний відділ або вражає обидва рівні), ризик раку набагато вищий, ніж у пацієнтів з антральним гастритом. 7 Гастрит корпусу, який пов’язаний із втратою париетальної клітинної маси (атрофією) та гіпо- або ахлоргідрією, дозволяє фекальним типам бактерій колонізувати шлунок, і існує думка, що ці організми можуть перетворити всередину нітрат у нітрит, а потім у канцерогенні N нітрозосполуки . 6
Незрозуміло, які фактори відповідають за підвищений ризик раку в Японії порівняно з Великобританією, але здається обгрунтованою гіпотезою, що незалежно від основної причини у японського населення має бути більш важкий гастрит, що виникає в більш ранньому віці, і з корпус, а не антральний, переважний малюнок. Отже, метою цього дослідження було оцінити характер та тяжкість гастриту у пацієнтів, які скаржаться на диспепсію у Великобританії та Японії, з урахуванням віку.
Пацієнти та методи
Це було порівняльне дослідження поперечного перерізу, проведене в загальній лазареті Лідса та Національній онкологічній лікарні Токіо. Три ендоскопісти (T Gotoda у Токіо та L Gatta та G Naylor у Лідсі) провели два місяці спільних тренувань, забезпечуючи узгодженість відбору пацієнтів, рекрутингу та місць біопсії, обробки гістологічних та мікробіологічних зразків, взяття крові та зберігання.
Схвалення етики для дослідження було отримано від місцевих комітетів з етики. У Лідсі пацієнтів приймали на роботу з клініки диспепсії, що діє на одній зупинці. Пацієнти давали письмову згоду на день, якщо погодились взяти участь у дослідженні. У Токіо подібним чином зверталися до пацієнтів, які відвідують відділення ендоскопії Національної онкологічної лікарні, спеціально для дослідження диспепсії.
Гістологія
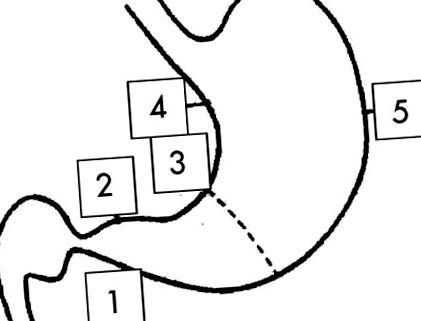
Зразки біопсії відбирали із застосуванням стандартних щипців для ендоскопічної біопсії з п’яти місць, зазначених в оновленій системі Сіднея (рис. 11). 11
Фігура 1 Місця біопсії для сіднейської системи: 1, 2 = антральний відділ (приблизно 2 см від пілоруса), 3 = різець (центр), 4 = менша крива (посередині між різцем та кардією) і 5 = більша крива (центральна, навпроти 4).
Зразки поміщали в 10% формалін, а потім вносили у парафін для секціонування. У кожному центрі було зроблено три набори слайдів; один набір фарбували гематоксиліном та еозином. Потім їх оцінював гістопатолог у кожному центрі (професор М. Діксон (доктор медичних наук) у Лідсі та професор Т. Шимода (TS) у Токіо). Другий набір був відправлений незабарвленим в інший центр, де проходило фарбування гематоксилін-еозином та проводилась оцінка предметних стекол. Патологи були засліплені щодо віку та статі досліджуваних, але через різницю в лабораторній ідентифікації предметних стекол вони знали про їх походження. Градуйовані ознаки оцінювали як відсутні, легкі, середні чи важкі (0–3) відповідно до оновленої Сіднейської системи щодо поліморфної активності, хронічного запалення, ІМ та атрофії. Таким чином, було виготовлено два набори гістологічних даних щодо всього матеріалу з Лідса та Токіо, один - від японського патологоанатома, а другий - від „західного” патологоанатома. Крім того, ще два набори предметних стекол (по одному з Лідса та Токіо) були забарвлені в Лідсі модифікованою Гіемзою для виявлення H pylori (MD). Пацієнти вважалися позитивними на гістологічний гастрит (консенсусний гастрит) лише в тому випадку, якщо його діагностували обидва патологи.
хелікобактер пілорі
Для виявлення H pylori використовували три методи: гістологію, культуру та тестування на антитіла. Зразки антральної тканини та біопсії тіла поміщали відразу в культуральне середовище, а потім заморожували до -70 ° C. Їх культивували на 10% (об./Об.) Кров'яному агарі при 37 ° С в інкубаторах зі змінною атмосферою в мікроаеробних умовах в окремих центрах. Культури (Токіо) або біопсії (Лідс), де їх потім транспортують до єдиного центру (Лондон) для набору для отримання статусу CagA та генотипу VacA.
Дві серологічні проби були проведені на зразках від усіх пацієнтів. По-перше, імуноферментний аналіз антитіл IgG проти H pylori (HM-CAP; Enteric Products Inc., Вестбері, Нью-Йорк, США) зі значенням 1,8 прийняте як позитивне (чутливість 98,7%, специфічність 100%). По-друге, імуноблот-тест, який включав тестування на антитіла VacA та CagA, а також діагностику інфекції (Helocoblot 2.1; Genelabs Diagnostics, Сінгапур) (чутливість 96%, специфічність 95%).
- Що означає високий рівень холестерину для бюлетеня для собак
- Чому рівень ожиріння настільки низький в Японії, а високий на території США
- Систематичний огляд шлункової електростимуляції при лікуванні ожиріння Експертний огляд медичних наук
- Ultra Trim Keto; Таблетки для схуднення; Огляд, переваги, чи працює це
- Ультра-оброблена їжа; Рак; Цільнопродовольча рослинна дієта