Стаття
Чи можемо ми змінити дієтичні макроелементи та полегшити мітохондріальну хворобу?
ТУАЛЕТ. Aw, N. A. Youngson та J. W. O. Ballard
Школа біотехнологій та біомолекулярних наук, Університет Нового Південного Уельсу, Сідней, Австралія
Анотація
Мітохондрії є важливим регулятором фізичної форми організму та ключовою органелою, що перетворює енергію. Потік енергії в еукаріотів передбачає перетворення макроелементів, утворюючи субстрати, які керують мітохондріальним диханням. Зміна відносного співвідношення харчових макроелементів може вплинути на гнучкість метаболізму та змінити продукцію мітохондріальних метаболітів, таких як активні форми кисню (АФК), які можуть впливати на функції мітохондрій та впливати на здоров’я організму. У цьому огляді ми описуємо відмінності у виведенні мітохондрій через дієтичний склад макроелементів у осіб з мутаціями комплексу I. Несинонімічні мутації в субодиницях мітохондріального комплексу I є поширеною причиною ранніх захворювань мітохондрій. Ми обговорюємо можливість маніпулювання співвідношеннями макроелементів як лікування деяких випадків легкої мітохондріальної дисфункції.
Вступ
Вплив дієти на функції мітохондрій було давнім питанням в біомедичній науці. Виявлення взаємодії між дієтою та мітохондріями може призвести до знахідного механізму поліпшення здоров'я людини і може дати уявлення про патофізіологію мітохондріальних захворювань 1. Мітохондріальні функції визначаються щільною координацією між мтДНК, ядерною ДНК та метаболічним станом клітин, на який діє великий дієта. Механічно дієта може впливати на функції мітохондрій різних гаплотипів мітохондрій 2,3. Таким чином, ми припускаємо, що функцію мітохондрій потрібно буде пов'язувати з дієтою, щоб забезпечити більш чітке розуміння специфічних мутацій мітохондріальних генів.
Субодиниці ланцюга електронного транспорту функціонують для перетворення енергії, що міститься в поживних речовинах, у високоенергетичні зв’язки АТФ за допомогою окисного фосфорилювання (OXPHOS). Енергію та субстрати, що керують мітохондріальним диханням, можна отримати або за допомогою гліколізу глюкози, бета-окислення жирних кислот або окислення амінокислот 4,5. Кінцеві продукти дихання мітохондрій різняться між цими субстратними джерелами, і ці відмінності можуть посилити або полегшити мітохондріальну хворобу. У цьому огляді ми оцінюємо можливість використання різних дієтичних макроелементів для лікування пацієнтів з мутаціями мітохондріального комплексу I.
Макроелементи впливають на гнучкість метаболізму
Клітини повинні адаптувати окислення палива (окислення амінокислот, гліколіз та бета-окислення) до наявності палива (вуглеводів, білків та жирів), і це відоме як “гнучкість метаболізму” 6. Гнучкість обміну речовин має вирішальне значення для адаптації організму до різних фізіологічних умов, дозволяючи організмам переходити від одного виду палива до іншого у відповідь на зміни в харчуванні. Регулювання гнучкості метаболізму є складним і включає компенсаторні механізми, включаючи антероградні (ядерний контроль функцій мітохондрій) та ретроградні (ядерні зміни у відповідь на сигнали мітохондрій) 7-9. Можливо, що метаболічна гнучкість в основному зумовлена субстратом, як це описано в циклі Рендла. Цикл Рендла - це біохімічний механізм, який точно налаштовує баланс між окисленням глюкози та жирних кислот у м’язах та жировій тканині. Цей цикл регулює вибір палива та адаптує попит та пропозицію субстрату в тканині 10 .
Нещодавно було запропоновано зміни у складі дієтичних макроелементів, щоб змінити місце розташування електронів, що надходять в ЕТС, і, можливо, вплинути на метаболізм мітохондрій. Наприклад, електрони, які потрапляють через Комплекс I, можуть генерувати в цілому 10 Н +, але лише шість Н + можуть генеруватися, коли електрони обходять Комплекс I і потрапляють через Комплекс II 4 (через наявність поживних речовин, склад дієти або комплекс I мутація). Ці відмінності в концентрації протонів, спричинені різними точками входу, впливатимуть на трансмембранний електрохімічний градієнт і врешті-решт впливатимуть на швидкість АТФ, що продукується комплексом V 2. У наступному розділі ми обговоримо вплив макроелементів на функції мітохондрій. Як модель ми вивчимо мутації комплексу I, щоб полегшити розуміння цих взаємодій макроелементів та мітохондрій ДНК.
Мутації комплексу I
Вплив харчового білка на мутації комплексу I
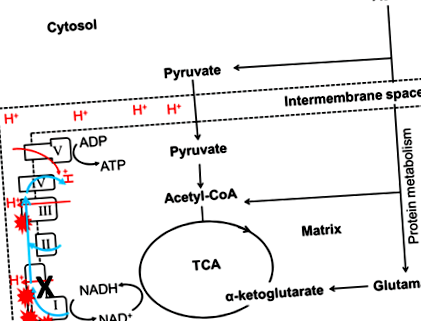
На сьогоднішній день лише кілька досліджень досліджували взаємозв'язок між макроелементами та мітохондріальними функціями. Дослідження дрозофіли показало, що мухи, що харчуються дієтою з високим співвідношенням білок: вуглеводи (Р: С), були пов'язані з вищою активністю цитратсинтази, яка є біомаркером вмісту мітохондрій 3. Крім того, було показано, що обмежений прийом незамінної амінокислоти метіоніну у щурів асоціюється із зменшенням вмісту мітохондрій, що супроводжується збільшенням функцій мітохондрій та зниженням окисного стресу 23-25. Дійсно, збільшене споживання метіоніну також збільшувало вироблення АФК у мітохондріях та окисне пошкодження ДНК мітохондрій у печінці щурів 26. Поєднуючи ці результати, це припускає, що споживання дієти з високим вмістом білка або певних амінокислот може збільшити АФК мітохондрій та вміст мітохондрій. Амінокислоти можуть генерувати АТФ лише мітохондріально залежно. Таким чином, більше АФК буде вироблятися, коли білки використовуються як основне паливо для виробництва енергії (рис. 1). Збільшення АФК призводить до посилення окисного стресу 27,28, який, як вважають, є основним фактором, що сприяє патогенезу деградації нейронів, пов’язаної з мітохондріальною хворобою 13,29, зниження фертильності 30 та діабету 31 .
Фігура 1: Вплив харчового білка на мутації комплексу I. I, II, III, IV та V позначали Комплекс I, Комплекс II, Комплекс III, Комплекс IV та Комплекс V відповідно. Цикл TCA генерує субстрати (NADH) для OXPHOS і використовує цей субстрат для підживлення дихання мітохондрій. Мітохондріальні комплекси збиратимуть електрони (синя лінія) із субстрату окислення та транспортуватимуть протони (червона лінія) у міжмембранний простір (пунктирна лінія). Мутації MtDNA в комплексі I (чорний хрест) знижують ефективність переносу електронів або транспорту протонів, що призводить до збільшення виробництва АФК (червоний вибуховий символ). У цьому випадку амінокислоти можуть генерувати АТФ лише мітохондріально залежно. Таким чином, більше АФК буде вироблятися, коли білки використовуються як основне паливо для виробництва енергії.
Клітинна концентрація кисню може також впливати на утворення АФК специфічним мітотипом. Як правило, менший вміст кисню генерує менше АФК, а більший вміст - більше АФК 32-34. Однак є приклади, коли утворення АФК запобігає або принаймні зменшує збільшення споживання кисню для зменшення клітинної концентрації кисню на 35-37. Ймовірно, мутації mtDNA, які спричиняють різницю в функціях мітохондрій, впливатимуть на швидкість споживання кисню 38, вироблення АТФ 39 і, отже, утворення АФК 39,40. Подальша робота над цими складовими ефектами буде важливою, якщо ці взаємодії слід повністю зрозуміти в питаннях здоров'я та хвороб.
Просто збільшення кількості мітохондрій в клітині для компенсації дисфункції не завжди є ефективною реакцією на мутації в генах мітохондрій. Для здорових мітохондрій підвищення регуляції вмісту мітохондрій спричинить невелику кількість продукції АФК, що може бути корисно для організму, оскільки для регуляції гомеостазу 41 необхідний низький рівень АФК. Однак збільшення вмісту мітохондрій може мати сильний вплив на організми, що містять мутації мтДНК 28. Наприклад, показано, що заміна His182Tyr у білку ND2 (частина комплексу I) у дрозофіли збільшує вироблення АФК у мітохондріях та погіршує вироблення енергії 3,17. Ця мутація ND2 індукує збільшення кількості копій мтДНК, але з компромісом із зменшеною тривалістю життя 16,17. Потенційно, регуляція нездорових мітохондрій забезпечить короткочасну користь для організму, але з часом може призвести до накопичення пошкоджень вільних радикалів з часом та індукувати клітинний цитотоксичний стрес. На підтвердження цього, недавнє дослідження на глистах показало, що дисфункція OXPHOS в мітохондріях призведе до активації розгорнутої мітохондріальної білкової реакції, розповсюдження шкідливих mtDNA та потенційно мітохондріальних захворювань 42 .
Вплив харчових вуглеводів на мутації комплексу I
Емпіричні дослідження показали, що дисфункція в мітохондріях може спричинити перехід від дихання мітохондрій до аеробного гліколізу для зменшення окисного стресу 43-46, що можна вважати ефектом, подібним до Варбурга 47. Насправді було показано, що цей перехід від мітохондріального дихання до аеробного гліколізу принаймні частково опосередкований дихальним комплексом I 48. Показано, що мутація помилок мітохондріального рибосомного білка S12 (tko), що знижує активність комплексу I, III та IV, змінює характер експресії генів у дрозофіли 49-51. Мітохондріальний рибосомний білок S12 кодується ядерними генами і відповідає за синтез білка в мітохондрії. Аналіз експресії генів у транскриптомі показує, що мутантні мухи tko 25t відчувають перемикання метаболізму для компенсації дефекту OXPHOS. Зокрема, мутантні мухи tko 25t відчувають підвищення регуляції лактатдегідрогенази, що передбачає перехід на гліколіз для виробництва АТФ 50. В даний час невідомо, чи цей перемикач є наслідком дисфункції комплексу I або ретроградної реакції, опосередкованої АФК.
Тут ми припускаємо, що потенційна ретроградна реакція на окислювальний стрес полягає у переключенні виробництва енергії з мітохондріально-залежного (мітохондріального OXPHOS) на мітохондріально-незалежний (гліколіз) шлях. Ми припускаємо, що ця реакція може бути ініційована лише у присутності вуглеводів, отже, дієти з високим вмістом вуглеводів повинні забезпечувати більш високу пластичність та мати конкретні переваги для організму, що містить несинонімічні мутації mtDNA в генах OXPHOS. Виходячи з цього, ми прогнозуємо, що дієти, багаті цукром, можуть потенційно полегшити мутантний фенотип, спричинений дисфункцією мітохондрій. Якщо гіпотеза підтримується, це може запропонувати потенційний шлях лікування макроелементами пацієнтів з підмножиною мітохондріальних захворювань. Потенційна проблема цієї гіпотези полягає в тому, що АТФ, що виробляється в результаті гліколізу, був би приблизно в 20 разів нижчим, ніж той, що продукується з OXPHOS. Однак перехід виробництва енергії з мітохондріального OXPHOS на гліколіз може також призвести до накопичення ліпідів, що може змусити організм використовувати ліпіди як альтернативне джерело палива 46 (Рисунок 2).
Малюнок 2: Вплив вуглеводів на мутації комплексу I. Мутація мітохондріального комплексу I спричиняє зміщення мітохондріального OXPHOS до гліколізу (зелена стрілка). Отже, виробляється менше АФК і більше лактату. Перетворення пірувату в лактат збільшить НАД + для продовження процесу гліколізу. Накопичення лактату з часом призведе до припинення гліколізу. Щоб уникнути цього, піруват буде перетворений в ацетил-КоА для ліпогенезу.
Вплив жиру на мутації комплексу I
Нещодавній огляд Ballard and Youngson 2 припустив, що зміни у складі дієтичних макроелементів можуть змінити точку входу електронів, що надходять в електронно-транспортну систему 40, і потенційно вплинути на функції мітохондрій. Можливо, що дієтичний жир може збільшити швидкість бета-окислення та змінити концентрацію FADH2 та NADH. Наприклад, метаболізм однієї молекули глюкози забезпечує співвідношення NADH: FADH2 5: 1, тоді як бета-окислення жирних кислот з довгим ланцюгом дає співвідношення NADH: FADH2 приблизно 2: 1 52 .
У цьому випадку злегка шкідлива несинонімічна мутація в мітохондріальному комплексі I може викликати більше відновлюючих еквівалентів у вигляді жирного ацил-КоА шляхом бета-окислення жирних кислот і викликати більшу частку FADH2. Ці відновлені кофактори FADH2 можуть згодом перекинути серію електронів до ETC за допомогою електронно-передавального флавопротеїну (ETF). ETF є компонентом ETC, який утворює ярлик для перенесення електронів з бета-окислення в ETF-убихінон-оксидоредуктазу (ETF-QO) 53. Системи ETF-QO можуть функціонувати як короткий електронний шлях, щоб обійти злегка шкідливий Комплекс I. Підкріплення цієї гіпотези є свідченням того, що нокаутовані миші NADH-убихінону оксидоредуктази 1 альфа-субкомплекс 5 (NDUFA5) мають збільшення ETF. Це припускає, що збільшення передачі електронів через ETF до UQ могло бути ініційоване як компенсаторний механізм для зменшення окисного стресу, викликаного комплексом I 54 .
Яка дієта найкраща при захворюваннях комплексу I?
У всьому світі зростає поширеність дієт з високим вмістом жирів та вуглеводів 55. Ці дієти виробляють високий рівень АФК, що є головним фактором розвитку метаболічних захворювань 56. Це середовище гіпер-харчування може погіршувати фенотипи пацієнтів із комплексом I, що потенційно штовхає людей із „легкими/субклінічними” мутаціями до продукування АФК на патогенних рівнях. Ми пропонуємо, щоб вищезгадані дослідження підтверджували думку, що певні дієти є більш сприятливими для хворих на мітохондріальні захворювання з дисфункцією комплексу I (Таблиця 1).
| Дієта з високим вмістом жирів (і кетогенна дієта) | Низький | Достатньо | Низький |
| Дієта з високим вмістом вуглеводів | Високий, тобто шкідливий | Достатньо | Високий |
| Дієта з високим вмістом вуглеводів з переходом на гліколіз, ліпогенез та бета-окислення | Низький | Достатньо | Низький |
| Дієта з високим вмістом вуглеводів, лише гліколіз | Низький | Низький | Високий |
| Дієта з високим вмістом білка | Високий, тобто шкідливий | Достатньо | Високий |
| Дієта з високим вмістом жиру та вуглеводами | Надзвичайно високий, тобто шкідливий | Достатньо | Залежить від відносного використання бета-окислення, гліколізу та пірувату в ТСА для отримання енергії |
Таблиця 1. Передбачувані варіації продуктів дієти при дисфункції комплексу I a
a Дієти, що виробляють низьку кількість АФК та достатню кількість АТФ із низьким співвідношенням NADH: FADH2, як передбачається, будуть корисними для осіб з легкою дисфункцією комплексу I OXPHOS.
Дієти з високим вмістом білка або дієти з високим вмістом вуглеводів, які виробляють велику кількість донора комплексу I NADH, є несприятливими через їхню схильність до утворення великої кількості АФК. Зменшення АФК і, отже, зменшення окисного стресу можна досягти двома шляхами. Або за рахунок зменшення дихання мітохондрій за рахунок посилення гліколізу, або обходу комплексу I за рахунок збільшення відносної кількості бета-окислення похідного жирного ацил-КоА. При підвищеному гліколізі відбувається компроміс між виробництвом АФК та виробництвом енергії, так що залежний від гліколізу метаболізм може не виробляти достатньо енергії для здоров’я. Однак перехід до бета-окислення при дієті з високим вмістом жирів або дієті з високим вмістом вуглеводів, що має посилений ліпогенез, може забезпечити достатнє виробництво енергії при мінімізації виробництва АФК.
Дієтичні втручання вже є одними з методів лікування, які зараз перевіряються у хворих на мітохондріальні захворювання. Кетогенні дієти (з високим вмістом жиру, помірного вмісту білка та з низьким вмістом вуглеводів), що сприяють мітохондріальному диханню, а не гліколізу для енергетичного обміну, були перевірені як терапія ряду захворювань, включаючи рак, епілепсію та мітохондріальну хворобу 57,58. На підтвердження використання кетогенних дієт для пацієнтів з мутаціями комплексу I є те, що дієти посилюють бета-окислення (що призведе до отримання більше жирного ацил-КоА, який обходить комплекс I через системи ETF-QO) та зменшує окислювальний стрес. Дієти також посилюють біогенез мітохондрій, що може бути несприятливим, якщо це збільшує кількість мутаційної мтДНК. Однак дослідження на клітинних лініях свідчать про те, що дієта може насправді призвести до гетероплазматичного зсуву, що збільшує відносну кількість немутованих мтДНК 58,59 .
Цікаво, що деякі лікарські засоби, які зараз випробовуються для пацієнтів з дисфункцією мітохондріального комплексу I, впливають на ті самі процеси, що і дієтичні втручання (оглянуто в Koopman, et al. 60). Такі препарати, як куркумін, ідебенон та EPI-743, підвищують рівень клітинних антиоксидантів для зниження рівня АФК. Ідебенон також доставляє електрони безпосередньо до комплексу III, тим самим минаючи дефіцитний комплекс I. Добавки коензиму Q10/убихінону протестували насамперед на його антиоксидантні властивості, але він також може збільшити функцію системи ETF-QO, щоб дозволити обійти комплекс I.
Існує кілька потенційних застережень щодо терапевтичного потенціалу дієт з високим вмістом жирів або вуглеводів. Зокрема, потенційний ризик виникнення ожиріння при високоенергетичних дієтах. Крім того, для того, щоб оцінити потенціал запропонованих дієт для лікування пацієнтів із мітохондріальними захворюваннями комплексу I, нам також потрібно визначити, чи є збільшення ліпогенезу та бета-окислення метаболічно сприятливим при високовуглеводних дієтах. Нам також потрібно буде визначити, чи здатна система ETF-QO регулюватися в достатній мірі для задоволення енергетичних потреб. Потрібно провести більше роботи в модельних організмах (наприклад, дрозофіла, миші), щоб перевірити доцільність цих дієтичних втручань щодо комплексу I. Для того, щоб зрозуміти вплив дієт на енергетичний обмін, вимірювання метаболітів, включаючи АФК, АТФ, лактат (як маркер для гліколізу), малоніл-КоА (як маркер для ліпогенезу), кетони (як маркер жирових похідних енергетичний метаболізм), і буде потрібно співвідношення NADH: FADH2 (при флуоресцентній мікроскопії) 61. Потенційно метод вимірювання співвідношення NADH: FADH2 може вимагати певного технічного розвитку в живому організмі.
Висновки
Ми припускаємо, що рідкісні захворювання людини, які спричинені мутацією мітохондріального комплексу I, посилюються внаслідок дієтичного складу макроелементів. Крім того, сучасні дані свідчать про те, що дієта може модулювати функції мітохондрій та впливати на здоров’я організму. Якщо це правда, це передбачає можливість маніпулювання співвідношеннями макроелементів як лікування деяких захворювань, пов'язаних з дисфункцією мітохондрій.
- Зміни дієтичного вмісту жиру та вуглеводів змінюють центральний та периферійний годинник у людей -
- Опис фракцій подрібнення гречаних насіння, склад макроелементів та харчові волокна -
- Дієта з 6 порад - спрощений дієтичний підхід у пацієнтів із хронічними захворюваннями нирок
- Рандомізоване 6-тижневе дослідження дієти з низьким вмістом FODMAP у пацієнтів із запальними захворюваннями кишечника -
- Огляд дієтичних (фіто) поживних речовин для підтримки глутатіону - PubMed