Чи може хіміотерапія усунути передачу гельмінтів, що передаються ґрунтом?
Анотація
Передумови
Серед найбідніших верств населення світу за останні роки різко зросла доступність антигельмінтних засобів для боротьби з гельмінтами, що передаються ґрунтом (STH) за допомогою масової або цільової хіміотерапії. Однак розробка програм лікування на базі громади для досягнення найбільшого впливу на передачу все ще залишається предметом дискусій. Питання включають: кого слід лікувати, як часто їх слід лікувати, як довго слід продовжувати лікування?
Методи
Моделювання та аналіз динамічної моделі передачі та нові аналізи даних пропонують уточнення керівних принципів Всесвітньої організації охорони здоров’я щодо лікування СТГ на базі громади.
Результати
Цей аналіз показує, що рівні та частота лікування повинні бути набагато вищими, а ширина охоплення за віковими класами ширша, ніж зазвичай є поточною практикою, якщо передача повинна бути перервана лише масовою хіміотерапією.
Висновки
Плануючи втручання для зменшення захворюваності, а не суто для зменшення захворюваності, сучасних втручань у школі навряд чи буде достатньо для досягнення бажаних результатів.
Передумови
Серед найбідніших верств населення у світі фінансування боротьби з ґрунтовими гельмінтами (STH) за допомогою масової або цілеспрямованої хіміотерапії неухильно зростало протягом останніх 10 років завдяки щедрим пожертвам міжнародних агентств допомоги багатішим країнам, благодійних організацій та фармацевтичних компаній [1 ]. Стимульований Дорожньою картою Всесвітньої організації охорони здоров’я (ВООЗ) до 2020 року щодо боротьби із занедбаними тропічними хворобами, дух цих розширених зусиль зафіксовано в Лондонській декларації в січні 2012 року та звіті про прогрес через рік [2–4] . Проте залишається багато питань щодо того, як найкраще проводити програми лікування інфекцій, що спричиняють ІПСШ, на базі громади, щоб досягти найбільшого впливу. До них належать такі: кого слід лікувати, як часто їх слід лікувати, як довго слід продовжувати лікування, чи можна збільшувати інтервали лікування у міру падіння глистяних навантажень і чи можна усунути передачу шляхом повторної хіміотерапії? [5, 6] . Щоб відповісти на ці запитання, потрібно детально зрозуміти динаміку передачі паразитів.
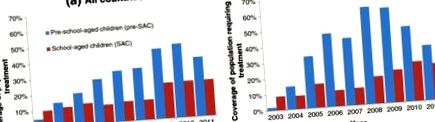
Сучасні рекомендації щодо популяційного лікування інфекцій STH зосереджені на лікуванні дітей дошкільного віку (pre-SAC) у віці від 2 до 4 років та дітей шкільного віку (SAC) у віці від 5 до 14 років [7, 8], завдяки вимірюваній користі для здоров’я та низькій вартості та простоті днів здоров’я дітей та шкільних програм охорони здоров’я, що використовуються для лікування [9, 10]. Вплив збільшення фінансування на охоплення в цих вікових групах проілюстровано на рисунку 1, який показує високий рівень охоплення серед дітей дошкільного віку, що збільшується серед дітей шкільного віку. Розробка та оцінка багатьох програм контролю заснована на вимірах поширеності (фракція інфікованих [11, 12]) та інтенсивності зараження (навантаження глистами або концентрація яєць паразитів у фекаліях людини як сурогат навантаження глистами [13, 14]) . У цій роботі ми використовуємо математичну модель для дослідження можливості локальної елімінації паразитів у межах громади шляхом регулярних хіміотерапевтичних втручань та її залежності від основної сили передачі та ефективного охоплення лікування у ключових вікових групах до SAC, SAC і дорослих.
Висвітлення профілактичної хіміотерапії STH у дітей дошкільного віку (Pre-SAC, синій) та дітей шкільного віку (SAC, червоний), (a) на міжнародному рівні та (b) Африканський регіон ВООЗ, розрахований ВООЗ як частка від загальної кількості населення до-SAC та SAC, які проживають у всіх ендемічних районах країни, що потребує профілактичної хіміотерапії СТГ до 2003–2011 рр.[1].
Методи
Використана математична модель описує еволюцію розподілу паразитів у різних вікових групах господаря та вплив періодичної хіміотерапії на тягарі господаря, включаючи ключові епідеміологічні та біологічні процеси, що впливають на передачу. Спираючись на минулі дослідження [15, 16], він включає спостережувані особливості статевого розмноження дводомними гельмінтами, неоднорідність впливу інфекції за віком господаря, коливання інтенсивності передачі в різних людських спільнотах, агрегований розподіл чисельності глистів на хазяїна і зниження плодючості як функція глистового навантаження (залежність від щільності) [16–18]. Динаміку передачі при повторних циклах лікування досліджують для трьох основних кишкових нематод, Ascaris lumbricoides, Trichuris trichuria анкилостоми (Necator americanus і Ancylostoma duodenale). Модель детально описана в Додатковому файлі1, доступному в Інтернеті.
Хоча в модель закладено повний віковий розподіл, ми використовуємо ключові вікові групи, описані вище, щоб визначити рівні охоплення втручаннями та проілюструвати їх ефект. Це немовлята (віком від 0 до 1 року), яких не можна лікувати згідно з чинною ліцензією на основні антигельмінтні препарати, що широко застосовуються (наприклад, альбендазол та мебендазол), діти дошкільного віку (до САК, віком 2–4 роки), діти шкільного віку (SAC, віком 5–14 років) та дорослі (віком від 15 років). Досліджуються різні комбінації фракції, обробленої у кожній віковій групі, частота обробки та тривалість лікування. Фракція в кожній групі, яка ефективно обробляється, є продуктом фракції, яка отримує лікування, та ефективності лікарського засобу (визначається як частка вигнаних глистів). У рамках поточної моделі ці два аспекти лікування нероздільні, і охоплення населення представлено як частка вилікуваних глистів. Ефективність наркотиків, як правило, становить близько 90% і більше Аскарида і анкілостомів, але дещо менше для Трихуріс[19–22]. Слід зазначити, що оброблену фракцію ефективно вибирають випадковим чином із субпопуляції. Ця модель не стосується систематичного недотримання.
Життєві цикли цих паразитів включають стадії вільного проживання, які передаються у фекаліях господаря людини і дозрівають до стадії зараження у зовнішньому середовищі існування (яйця для Аскарида і Трихуріс і личинки для анкілостомів). Інфекційні стадії паразита в навколишньому середовищі представлені в моделі загальним пулом інфекційного матеріалу. Тривалість життя цих стадій, як правило, становить тижні до місяців за сприятливих умов навколишнього середовища, і вони виводяться з організму у дуже великій кількості [23–26]. Хоча ця тривалість невелика в порівнянні з тривалістю життя дорослих глистів у людини-господаря, інфекційний матеріал у навколишньому середовищі діє як резервуар, на який хіміотерапія не впливає і може відігравати значну роль у динаміці лікування. Динаміка ряду паразитів у популяції господаря може бути представлена однією і тією ж моделлю з різними діапазонами параметрів для різних видів (Див. Додатковий файл1: Таблиця S1).
Вважається, що різні вікові групи в різному ступені вносять вклад в цей інфекційний пул та піддаються його впливу. Вказівкою на це служать зміни інтенсивності зараження за віком; візерунки, як правило, опуклі для Аскарида і Трихуріс, але продовжують зростати на анкилостоми у віці [27–29] (рис. 2). Відповідні ролі вікового впливу інфекції в порівнянні з набутим імунітетом залишаються невизначеними, проте швидке повторне зараження усіма трьома паразитами після лікування вказує на те, що перше є головним фактором вікової інтенсивності профілів інфекції. На цій основі використовуються методи MCMC [30], щоб пристосувати модель до цих вікових моделей зараження, щоб оцінити як інтенсивність передачі (виміряну за базовим репродуктивним числом R0 - середньою кількістю потомства, виробленого однією самкою хробака, що виживає до репродуктивна зрілість) та віковий вплив. Ми намагалися вибрати типові або характерні профілі зараження для досліджуваних видів паразитів, сподіваючись, що наші результати будуть широко застосовними.
Профілі вікової інтенсивності середньої інтенсивності зараження (верхній ряд) та поширеності (%, другий ряд) для трьох основних ґрунтових гельмінтів; Аскарида [[27]] (ліва колонка), Трихуріс [[28]] (середня колонка) & анкилостома [[29]] (права колонка). Кольори вказують на вікову групу.
Результати
Результати представлені у двох форматах; а саме тривимірна поверхня ефективних комбінацій обробки pre-SAC, SAC та дорослих, що призводить до перетину критичної поверхні обробки для гасіння передачі паразитів (значення, рівні або вище поверхні, призводять до тривалого вимирання), і часові ряди повторне лікування різної пропорції з трьох вікових груп лікування, щоб визначити, як довго лікування повинно тривати до припинення передачі. Вони представлені на рисунках 3 та 4 відповідно для двох форматів. Паразит з найбільшим значенням R0 визначає інтенсивність, частоту та тривалість необхідного лікування. Графіки призначені для Аскарида і лише анкилостома, оскільки Трихуріс демонструє дуже схожі візерунки Аскарида з точки зору його віково-інтенсивного профілю, за винятком ефективності ліків, є дещо нижчою.
Критична обробка поверхонь для Аскарида (рядок 1: a, b, c та 3: g, h, i) та анкилостома (рядок 2: d, e, f). Репродуктивне число R0 - це 2, 3 та 5 у стовпцях 1 (a, d, g), 2 (b, e, h) та 3 (c, f, i) відповідно. У рядках 1 (a, b, c) та 2 (d, e, f) лікування проводиться щорічно, тоді як у рядку 3 (g, h, i) лікування проводиться кожні 6 місяців. Параметри моделі, як у додатковому файлі1: Таблиця S2. Ефективно оброблена пропорція (пропорція, оброблена х ефективність препарату) у кожній віковій групі (до SAC, SAC та дорослі) повинна лежати над "критичною" поверхнею на 3D-ділянках (на плато 1,0 всі повинні лікуватися ефективно) для викорінення відбуватися. Кольори вказують на покриття в SAC.
Чисельні рішення моделі для різних параметрів передачі (R 0 2 (a, d), 3 (b, e) і 5 (c, f)) та щорічне (a, b, c) або двічі на рік (d, e, f) лікування з 80% лікування в SAC та SAC. Показано, що середнє навантаження глистами у немовлят (чорний), Pre-SAC (синій), SAC (червоний) та дорослих (оранжевий) зменшується з часом. Інші параметри, як у додатковому файлі1: Таблиця S2.
Поточні рекомендації рекомендують проводити лікування кожні 12 місяців у низьких та середніх умовах передачі та кожні 6 місяців у високих показниках передачі [7, 8]. Результати моделі показують, що цільовий рівень охоплення може бути зменшений, якщо лікування проводити частіше, наприклад кожні 6 місяців. Це показано для Аскарида на малюнку 3g, де при низьких та середніх налаштуваннях передачі критичний поріг лікування може бути досягнутий лише шляхом обробки SAC (вище 70% для R0 = 2 і вище 90% для R0 = 3). У високих налаштуваннях рівні обробки, які не ініціюють перетин поверхні порогового значення обробки, повинні підтримуватися безкінечно, щоб уникнути повернення до рівнів попереднього контролю. Збільшення частоти лікування (кожні 4 місяці) та/або зміни поведінки та санітарії, що обмежують забруднення навколишнього середовища інфекційними стадіями (і, отже, зниження значення R0), будуть потрібні, якщо буде відбуватися ліквідація передачі.
Проміжок часу, протягом якого може бути досягнуто усунення, дуже чутливий до деталей втручання та налаштувань передачі. На рисунку 4 показано реакцію на тягар паразитів у чотирьох вікових категоріях на 80% ефективного охоплення preSAC та SAC. Для низьких значень R0 та щорічного лікування для Аскарида, поріг можна переступити через 10 років при високому (80%) лікуванні (рис. 4а). При 6-місячному лікуванні час скорочується приблизно до 6 років (рис. 4г). Лікування на цій частоті також дозволяє елімінацію при R0 = 3. Однак процес займає більше 20 років. Як показано на малюнку 3, елімінація, як правило, неможлива для середньої та високої передачі. Малюнок 4b, c, f показує, що було досягнуто нове «врегульоване» черв’ячне навантаження. Загалом, зменшення загальної ефективності та частоти лікування призводить до відновлення глистового навантаження серед населення. Однак попередні результати свідчать про те, що якщо повторне лікування може наблизити навантаження глистів на громаду досить близько до критичного рівня, на якому елімінація неминуча, можливо, можна послабити втручання без значного відновлення паразита. Це явище є об’єктом подальшої роботи.
Обговорення
Поверхні, показані на малюнку 3, чітко показують, що усунення аскариди виключно шляхом шкільної дегельмінтизації неможливо, за винятком випадків, коли налаштування передачі є найнижчими. Також вимагається додаткове охоплення дітей дошкільного віку та/або дорослих. Для анкилостомозу важливим є охоплення дорослих. Поверхні вказують, які діапазони ефективного покриття дозволять усунути, але не скільки часу може тривати процес. Як видно з рисунка 4, мета елімінації може бути досягнута через 5–6 років або протягом декількох десятиліть і може бути дуже чутливою до деталей охоплення лікуванням та динаміки паразитів у популяції господаря.
Наша модель забезпечує розуміння оптимального підходу до контролю СТГ, але наш підхід не позбавлений обмежень. Залишається багато невизначеності щодо характеру динаміки передачі між окремими людьми. Незважаючи на те, що за рівнями інфекційних контактів можна визначити базовий профіль зараження, мало що можна сказати про природу процесу зараження чи про те, чи є найкращим зразком єдиний екологічний резервуар. Ми вирішили використовувати модель «струмка» процесу зараження, а не модель «злипання», головним чином завдяки її зручності в рамках детермінованої парадигми моделі [42]. Інші роботи показали, що модель злипання може мати значний вплив на реакцію моделі на лікування та її чутливість до значень параметрів [42, 43]. Для вирішення цих питань знадобляться поздовжні терапевтичні випробування, що реєструють дані за різними часовими точками як від пролікованих, так і від необроблених вікових груп протягом 3–5 років. Наразі такі випробування тривають у Кенії.
Деталі структури моделі та точні значення параметрів важливі лише в тому випадку, якщо модельована поведінка чутлива до них. У цій роботі ми не включали офіційний аналіз чутливості, але чисельні дослідження показують, що групування параметрів, на яких ми зосередилися (тривалість життя хробака), Р. 0 і пропорція та частота ефективного лікування) - це ті, до яких модель найбільш чутлива. Агрегація хробаків серед господарів (k), часові шкали інфекційного матеріалу в навколишньому середовищі (μ 2 ) і демографія населення не мають сильного впливу на результати. Ми досліджуємо припущення щодо відкладення яєць та зараження інфекцією в різному віці в наступній публікації [44].
Сучасна модель також не враховує систематичного недотримання повторних обробок, що може створити резервуар передачі, до якого важко дістатись. Ймовірно, певні групи частіше систематично відмовляються від лікування, і для орієнтації на ці групи потрібні додаткові зусилля [45]. Це явище є предметом постійної роботи.
В даний час глобальні зусилля щодо контролю над СТГ зосереджені на збільшенні охоплення лікуванням дітей шкільного віку до 75% - цілі, яка обґрунтовується щодо переваг для здоров'я та освіти від лікування цієї вікової групи і яка є досяжною, враховуючи поточні програми донорства ліків та збільшення фінансування. Досягнення цієї мети охоплення повинно залишатися пріоритетом національних урядів та міжнародного співтовариства. Однак існує додатковий потенціал перервати передачу шляхом розширення лікування на додаткові вікові групи та збільшення частоти лікування в деяких умовах. Проводиться робота з перевірки наших моделей наявними даними та оцінки впливу різних стратегій лікування в градаційній серії рандомізованих оцінок у контрастних умовах передачі.
Висновок
Цей модельний аналіз показав, як можливість порушення циклу передачі паразитів залежить від вікових груп, які лікуються, охоплення та ефективності лікування та виду, про який йдеться. Наші результати чітко вказують на те, що при плануванні зменшення або усунення передачі, а не просто зменшення захворюваності, лікування дітей шкільного віку буде недостатнім; необхідне певне лікування дітей дошкільного віку або дорослих залежно від умов передачі та виду глистів.
- 10 способів ґрунтові поживні речовини схожі на поживні речовини людини; Живильні речовини для життя
- Уникання паразитів разом з домашніми тваринами
- Альтернативний цілісний підхід до лікування паразитних інфекцій в районі затоки Сан-Франциско
- Аюрведична порада тижня Диня - їжте її наодинці або залиште в спокої
- Анксіолітичні ефекти фітолу Можлива участь GABAergic передачі - ScienceDirect