Частота та час прийому їжі у стані здоров’я та хвороб
Марк П. Меттсон
лабораторія нейронаук, Національний інститут старіння, Балтимор, MD, 21224;
b Кафедра нейронауки Медичної школи університету Джона Гопкінса, Балтимор, штат Медіка, 21205;
Девід Б. Елісон
c Центр дослідження харчування та ожиріння, Університет штату Алабама, Бірмінгем, Бірмінгем, Алабама, 35294;
Луїджі Фонтана
d Медичний факультет Вашингтонського університету в Сент-Луїсі, Сент-Луїс, Міссурі, 63130;
e Відділ клінічних та експериментальних наук, Університет Брешії, 25123 Брешія, Італія;
f CEINGE Biotecnologie Avanzate, 80145 Неаполь, Італія;
Мішель Харві
g Центр профілактики раку молочної залози Genesis, Університетська лікарня Південного Манчестера, Wythenshaw, M23 9LT Manchester, Великобританія;
Вальтер Д. Лонго
h Інститут довголіття, Школа геронтології Девіса та Відділ біологічних наук, Університет Південної Каліфорнії, Лос-Анджелес, Каліфорнія, 90089;
Віллі Дж. Малайсс
i Лабораторія експериментальної гормонології, Брюссельський вільний університет, B-1070 Брюссель, Бельгія;
Майкл Мослі
j Британська телерадіомовна корпорація, W1A 1AA Лондон, Великобританія;
Люсія Ноттерпек
k Департамент нейронауки Медичного коледжу Інституту мозку Мак-Найта, Університет Флориди, Гейнсвілль, Флорида, 32610;
Ерік Равуссен
l Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Лос-Анджелес, 70808;
Френк А. Дж. Л. Шеер
m Гарвардська медична школа та лікарня Бригама та жінок, Бостон, Массачусетс, 02115;
Томас Н. Сейфрід
n Біологічний факультет, Бостонський коледж, Chestnut Hill, MA, 02467;
Криста А. Варади
o Департамент кінезіології та харчування, Університет Іллінойсу, Чикаго, Чикаго, Іллінойс, 60612; і
Сатчідананда Панда
p Нормативна лабораторія біології, Інститут біологічних досліджень Солка, Ла-Хойя, Каліфорнія 92037
Вклад автора: M.P.M., D.B.A., L.F., M.H., V.D.L., W.J.M., M.M., L.N., E.R., F.A.J.L.S., T.N.S., K.A.V. і S.P.
Анотація
Хоча великі дослідницькі зусилля були зосереджені на тому, як конкретні компоненти харчових продуктів впливають на здоров'я, порівняно мало відомо про більш фундаментальний аспект дієти, частоту та циркадні терміни прийому їжі, а також потенційні переваги періодичних періодів, коли енергія не надходить або дуже низька. Найпоширеніший режим харчування в сучасному суспільстві, триразове харчування та закуски щодня, є ненормальним з точки зору еволюції. Результати досліджень моделей тварин та людей, що виникають, свідчать про те, що періодичні періоди обмеження енергії, що становлять лише 16 годин, можуть покращити показники здоров’я та протидіяти процесам захворювання. Механізми включають метаболічний зсув до метаболізму жиру та вироблення кетонів, а також стимулювання адаптивних реакцій клітинного стресу, що запобігають та відновлюють молекулярні пошкодження. Оскільки дані про оптимальну частоту та час прийому їжі кристалізуються, надзвичайно важливо буде розробити стратегії, що враховуватимуть такі режими харчування у політиці та практиці охорони здоров’я та способі життя населення.
Еволюційні та культурні міркування
На відміну від сучасних людей та одомашнених тварин, режим харчування багатьох ссавців характеризується періодичним споживанням енергії. Хижаки можуть вбивати та їсти здобич лише кілька разів на тиждень або навіть рідше (3, 4), а антропоїди мисливців-збирачів, включаючи тих, хто живе сьогодні, часто харчуються з перервами залежно від наявності їжі (5, 6). Здатність функціонувати на високому рівні як фізично, так і розумово протягом тривалих періодів без їжі могла мати принципове значення в нашій еволюційній історії. У ссавців зберігається багато пристосувань для періодичного надходження їжі, включаючи органи для поглинання та зберігання швидко мобілізується глюкози (запаси глікогену в печінці) та енергії, що зберігається довше, наприклад, жирних кислот у жировій тканині. Поведінкові адаптації, що дозволяють отримувати та зберігати їжу, пронизують поведінковий репертуар усіх видів, включаючи людей. Дійсно, вищі когнітивні можливості людини в порівнянні з іншими видами, ймовірно, еволюціонували з метою придбання продовольчих ресурсів; дані свідчать про те, що найдавніші інструменти (7) та мови (8) були винайдені, щоб допомогти у придбанні їжі.
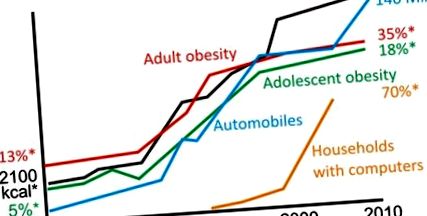
Сільськогосподарська революція, що розпочалась 10 000 років тому, призвела до постійної цілорічної доступності їжі, характерної для сучасних суспільств. Наші предки-аграрії прийняли режим харчування три рази на день, мабуть, тому, що він забезпечував як соціальні, так і практичні переваги для повсякденної роботи та розкладу шкільних занять. Зовсім недавно, протягом останніх 50 років, харчові продукти з високою калорійністю (рафіновані зерна, цукор, кулінарні олії, кукурудзяний сироп тощо) пронизували ці три щоденні прийоми їжі (9). При накладенні на все більш сидячий спосіб життя споживання високоенергетичної їжі кілька разів на день правдоподібно сприяло появі ожиріння та пов'язаних із ним захворювань як основних причин захворюваності та смертності (рис. 1). Ожиріння також стало головною проблемою здоров'я собак і котів, яких часто годують за бажанням (10), і навіть лабораторних гризунів часто можна вважати перегодованими та малорухливими (11, 12). Дійсно, тварини в дикій природі та люди, які збирають мисливців, рідко, якщо взагалі коли-небудь страждають ожирінням, діабетом та серцево-судинними захворюваннями (5).
Приплив ожиріння, що наростає, тісно пов’язаний із щоденним споживанням калорій та транспортом, що сприяє малорухливому способу життя (посилання 84–86; www.earth-policy.org/data_center/C23). * США, приблизне значення. # Всесвітнє автовиробництво.
Добові ритми, час харчування та здоров’я
Циркадні ритми - це самостійні ∼24-годинні коливання в поведінці, фізіології та обміні речовин. Ці ритми еволюціонували і дозволяють організмам ефективно реагувати на передбачувану щоденну зміну світла: темний цикл та результуючі ритми в наявності їжі в природі. Дослідження експресії генів виявили, що понад 10% експресованих генів у будь-якому органі мають циркадні коливання (13). Ці ритмічні транскрипти кодують ключові етапи, що визначають швидкість у нейроендокринних, сигнальних та метаболічних шляхах. Така регуляція тимчасово відокремлює несумісні клітинні процеси та оптимізує клітинну та організмову форму. Хоча цілодобовий годинник є автономним для клітин і присутній у більшості типів тканин, циркадна система організована в ієрархічному порядку, коли надгіазматичне ядро гіпоталамуса (SCN) функціонує як головний циркадний годинник, який використовує як дифузійні, так і синаптичні механізми для організувати циркадні ритми в периферичних органах у відповідну фазу. Фоторецептивні клітини сітківки сітківки надсилають інформацію про навколишнє світло до SCN за допомогою моносинаптичного з'єднання, щоб забезпечити залучення циркадної системи до денного циклу світло: темрява (14).
Механізм, що лежить в основі сприятливого ефекту TRF, ймовірно, складний і діє на декілька шляхів. Щоденні епізоди натще і годування викликають альтернативну активацію білка-зв'язуючого елемента відповіді на цАМФ (CREB) та AMP-кінази, що відповідає голодуванню, а також годування чутливими до інсуліну залежними ссавцями цілей рапаміцину (mTOR), пов'язаних з метаболічним гомеостазом. Крім того, ці шляхи також впливають на циркадні годинники та покращують стійкість коливань годинникових компонентів та цілей, що знаходяться нижче за течією (23). Відповідно, дослідження експресії генів показують, що TRF підтримує циркадну ритмічність тисяч транскриптів печінки (26).
Злиття геноміки та генетики у мишей розкриває шляхи від основних компонентів годинника до конкретного метаболізму поживних речовин. Рецептори ядерних гормонів REV-ERB є невід'ємною частиною циркадного годинника і безпосередньо регулюють транскрипцію кількох ключових ферментних факторів, що визначають метаболізм жирних кислот та холестерину (27). Хоча криптохромні білки є сильними пригнічувачами транскрипції, вони також інгібують передачу сигналів цАМФ і тим самим налаштовують опосередкований CREB глюконеогенез (28). Фактори транскрипції циркудіанного годинника DBP/TEF/HLF регулюють метаболізм ксенобіотиків (29), а KLF15 опосередковує метаболізм азоту (30). Ці та інші режими регуляції (31) забезпечують механістичну основу, за допомогою якої час прийому їжі впливає на циркадні годинники і, в свою чергу, впливає на метаболічний гомеостаз у ссавців.
Добова фаза не тільки впливає на метаболічну реакцію на прийом їжі, нещодавно було доведено, що саме вживання їжі знаходиться під контролем ендогенної циркадної системи, незалежно від циклу сну/неспання та голодування/годування (32), можливо, допомагаючи пояснити, чому сніданок часто є найменшою їжею за день або навіть пропускається все разом.
Клітинні та молекулярні механізми: розуміння періодичного обмеження енергії та голодування
Порівняно з тими, що харчуються ad libitum, тривалість життя організмів від дріжджів та глистів, до мишей та мавп може бути продовжена за рахунок обмеження дієтичної енергії (33–35). Дані, зібрані від осіб, які практикують суворі дієтичні обмеження, вказують, що люди зазнають багатьох однакових молекулярних, метаболічних та фізіологічних адаптацій, типових для довгоживучих CR-гризунів (36). IER/голодування може запобігти і навіть змінити хворобливі процеси на тваринних моделях різних видів раку, серцево-судинних захворювань, діабету та нейродегенеративних розладів (2). Тут ми коротко виділимо чотири загальні механізми, за допомогою яких ІЕР захищає клітини від травм та хвороб.
Адаптивні реакції на стрес.
Біоенергетика.
Метаболічний зсув до кетогенезу, який відбувається при посиленні нейрональної біоенергетики натще. Запаси глікогену печінки, як правило, виснажуються протягом 10–12 год після голодування, що супроводжується виділенням жирних кислот з клітин жирової тканини в кров. Потім жирні кислоти транспортуються до клітин печінки, де вони окислюються, утворюючи ацетил-КоА. Потім ацетил-КоА перетворюється на 3-гідрокси-3-метилглюарил-КоА, який, у свою чергу, використовується для утворення кетонів ацетоацетату та β-гідроксибутирату (β-ОНВ). Кетони виділяються в кров і транспортуються в різні тканини, включаючи мозок, де вони забираються нейронами і використовуються для вироблення ацетил-КоА. Ацетил-КоА вступає в цикл трикарбонової кислоти (ТСА) для утворення АТФ.
У той час як ІЕР/голодування є корисним, а переїдання шкідливим для багатьох типів нормальних клітин, зворотне стосується пухлинних клітин. Клітини пухлин виявляють основні мітохондріальні аномалії та генерують свій АТФ насамперед за рахунок гліколізу, а не окисного фосфорилювання (54). Більше того, пухлини сильно васкуляризовані, і тому їх клітини мають доступ до великої кількості циркулюючої глюкози. Моделі на тваринах послідовно показували, що ІЕР пригнічує і навіть зворотно зростає цілий ряд пухлин, включаючи нейробластому, рак молочної залози та яєчників (55). Перехід до кетогенезу може зіграти важливу роль у придушенні росту пухлини за допомогою IER/голодування, оскільки багато клітин пухлини в основному не можуть використовувати кетони як джерело енергії; відповідно, кетогенні дієти можуть посилити протипухлинні ефекти ІЕР (54). Хоча попередні дослідження останніх випадків у пацієнтів з людьми пропонують можливе застосування ІЕР для лікування ряду видів раку, включаючи молочну залозу, яєчники, простату та гліобластому (56, 57). Дійсно, еволюційна теорія передбачає, що зібрані випадкові мутації будуть перешкоджати пухлинним клітинам здійснювати необхідні метаболічні адаптації до IER (58).
Запалення.
Покращений ремонт та видалення пошкоджених молекул та органел.
Клітини мають спеціальні механізми для видалення пошкоджених молекул та органел. Один із механізмів включає молекулярне «мічення» пошкоджених білків убиквітином, що спрямовує їх на деградацію в протеасомі (66). У другому і більш досконалому механізмі, який називається аутофагія, пошкоджені та дисфункціональні білки, мембрани та органели спрямовуються до лізосом та деградують (67). Доведено, що споживання енергії та поживних речовин (особливо амінокислот) постійно впливає на аутофагію. Коли організми поглинають регулярний прийом їжі, їх клітини отримують відносно стабільний запас поживних речовин і, таким чином, залишаються в «режимі росту», в якому синтез білка є надійним, а аутофагія пригнічена (68). Шлях mTOR, що реагує на поживні речовини, негативно регулює аутофагію. Відповідно, голодування інгібує шлях mTOR і стимулює аутофагію в клітинах багатьох тканин, включаючи печінку, нирки та скелетні м’язи (69–71). Таким чином, голодування «очищає» клітини від пошкоджених молекул та органел.
Щури, що утримуються на дієтах з обмеженим енергоспоживанням, демонструють знижене накопичення поліубіквітінованих білків та свідчать про підвищену аутофагію в периферичних нервах порівняно з щурами, яких годували ad libitum. У миші на моделі Charcot-Marie-Tooth типу 1А, спадковому розладі, що характеризується демієлінізацією периферичних нервів, IER покращив моторні показники та зменшив демієлінізацію за допомогою механізму, що передбачає посилену аутофагію та зменшення накопичення агрегатів білка мієліну PMP22 (73). Спільною рисою багатьох основних хронічних захворювань є аномальне/надмірне накопичення білкових агрегатів усередині і поза клітин; приклади включають внутрішньоклітинний α-синуклеїн при хворобі Паркінсона та позаклітинний амілоїд β-пептид та внутрішньоклітинний білок Тау при хворобі Альцгеймера (74, 75). На додаток до частоти прийому їжі, циркадні терміни прийому їжі, ймовірно, впливатимуть на реакцію клітинних механізмів на очищення пошкоджених білків та органел (76). Аутофагія регулюється в добовому ритмі у багатьох типів клітин, і цей ритм можна змінити, змінивши час прийому їжі. Тому доцільно вважати, що час прийому їжі впливає на захворювання, що включають порушення або недостатню аутофагію.
Загальносуспільні наслідки
Закономірності щоденного та тижневого споживання їжі. На верхньому малюнку показано п’ять різних моделей споживання їжі протягом 24-годинного періоду. В: З’їдання трьох великих страв плюс закуски, розподілені протягом 16-годинного періоду неспання; це загальноприйнята схема споживання їжі, на якій з’явилася епідемія ожиріння, діабету та супутніх хронічних захворювань. B – D: Приклади, якщо обмежений у часі режим харчування, при якому їжа вживається як три (B) або два (C) звичайні страви, або три невеликі (D). E: Повна швидкість. Приклади щотижневих графіків прийому їжі наведені внизу праворуч. ER, обмеження енергії; IER, періодичне обмеження енергії; TRF, обмежене в часі годування.
Майбутні напрямки
Було б особливо цінним розробити RCT у людей із порівнянням різних схем прийому їжі, як показано на рис. 3. Щойно встановлять схему харчування, яка сприяє оптимальному здоров’ю, що можна зробити, щоб заохотити, дати можливість і розширити можливості людей змінювати свій вибір їжі та схеми харчування? Впровадження таких змін буде складним завданням, як свідчить півстолітнє дослідження поведінкових підходів до контролю ваги. Тим не менш, галузь науки про поведінку постійно розвивається, як і зростання та якість мобільних інформаційних технологій, які можуть слугувати підтримкою зусиль. Ми сподіваємось, що в майбутньому ми зможемо допомогти людям досягти здорових змін поведінки, яких вони бажають.
Подяка
Ця стаття включає інформацію з семінару-практикуму на тему “Харчові зразки та хвороби”, який можна переглянути за посиланням videocast.nih.gov/summary.asp?Live=13746&bhcp=1, та підтриманий Національним інститутом старіння Програми внутрішніх досліджень та Фонд медичних досліджень Глена. Відповідні дослідження в лабораторіях авторів підтримуються інтрамуральною підтримкою NIH (M.P.M.); Гранти NIH P30DK056336 (до DBA), P01AG034906 (до VDL), R01NS041012 (до LN), P30DK072476 (до ER), R01DK099512 (до FAJLS), R01NS055195 (до TNS), R01HL106228 (до01) K18); Сьома рамкова програма Європейського Союзу MOPACT [мобілізація потенціалу активного старіння в Європі; FP7-SSH-2012-1 Грант 320333 (L.F.)]; грант від Профілактики раку молочної залози Genesis, Великобританія (M.H.); та грант Бельгійського фонду наукових медичних досліджень 3.4520.07 (W.J.M.).
Виноски
Автори не заявляють конфлікту інтересів.
- Частота прийому їжі та втрата ваги - чи існує така річ, як зупинка метаболічного вогню
- Частота прийому їжі Скільки разів на день слід їсти Aaptiv
- Частота прийому їжі - огляд тем ScienceDirect
- Час прийому їжі може вплинути на рівень холестерину
- Прийом їжі; Зразок щоденного плану харчування