CASK - огляд тем ScienceDirect
Завантажити у форматі PDF
Про цю сторінку
Міжнародний огляд клітинної та молекулярної біології
3.1.2 CASK і Caskin
Сім'я Каскінів, що складається з двох членів, Каскіна-1 та -2 (ckn у дрозофіли), опосередковує передачу сигналу LAR-RPTP під час наведення рухового аксона за допомогою взаємодії, опосередкованої N-кінцевим доменом SAM, яка конкурує з зв'язуванням ліпрін-α (Венг та ін., 2011). Крім того, Caskin-1 зв'язується з білком-адаптером SH2/SH3 Dock/Nck та білками EphB1 через окремі домени для координації сигнальних шляхів, що беруть участь у зростанні аксонів та наведенні (Pesti et al., 2012). Однак його пресинаптична роль у нейронах ссавців, зокрема функція взаємодій CASK – Caskin, ще не досліджена.
Мозочок: розлади та лікування
Ginevra Zanni, Enrico Bertini, in Handbook of Clinical Neurology, 2018
Мікроцефалія з гіпоплазією понтину та мозочка (MICPCH) або синдромом CASK (MIM # 300749)
Вперше синдром CASK був описаний у 4-річної дівчинки, яка носила парацентричну інверсію de novo, судячи з усього, 46X, inv (X) (p11.4p22.3), порушуючи ген кальцій/кальмодулінозалежної серинової протеїнкінази (CASK), розташований за адресою Xp11.4, який кодує багатодоменний білок риштування, який належить до мембранно-асоційованого сімейства білка гуанілаткінази, виявленого в нейрональних синапсах, що беруть участь у торгівлі, націлюванні та передачі сигналів іонних каналів (Stevenson et al., 2000; Hsueh, 2009). У пацієнта спостерігалася помітна вроджена та постнатальна мікроцефалія, серйозна затримка розвитку, судоми та сенсоневральна втрата слуху. У неї були незначні аномалії обличчя: низький лоб, гіпертелоризм, широкий носовий місток, гладка кістка, великі вуха та мікрогнатія. Вона також мала епізодичну гіперпное та блідість зорового диска з анізокорією. МРТ головного мозку показала гіпоплазію мозочка, яка переважає у вермі, невеликий мост із сплощеним базисом, м'яко збільшеним четвертим шлуночком та зменшеною кількістю та складністю звивин корка.
Шляхом скринінгу серії пацієнтів з мікроцефалією, затримкою розвитку та гіпоплазією понтину та мозочка було виявлено дві гетерозиготні делеції, виявлені за допомогою масиву CGH, та одну помилкову мутацію в екзоні 21, що призвела до передчасного зупинки кодону у трьох дівчат із клінічним та нейрорадіологічним фенотипом дуже схожий на першого описаного пацієнта. Також була виявлена гемізиготна мутація, яка частково впливає на сплайсинг екзону 9 у сильно постраждалого хлопчика, який помер на 2 тижні (Najm et al., 2008). Гіпоплазія середнього заднього мозку була більш серйозною, мозолисте тіло було тонким і немієлінізованим, а кора показала область пахігірії. Невропатологічне дослідження мозочка показало погано сформовані та нерозгалужені листки, практично відсутній внутрішній зернистий шар та аномально товстий зовнішній зернистий шар. Молекулярний шар був гіперклітинним і дезорганізованим.
Три нові мутації missense та одна мутація CASK на місці сплайсингу були знайдені у чотирьох сім'ях з інтелектуальною недостатністю, пов'язаною з Х-легким та середнім ступенем, та вродженим ністагмом. Уражені особини, переважно чоловіки, мали нормальну окружність голови або відносну макроцефалію. Візуалізація мозку проводилася лише у двох із чотирьох сімей; у пропозиції однієї родини МРТ показала пахігірію та гіпоплазію мозочка, тоді як в іншій сім’ї, в якій половина постраждалих осіб мала нормальний когнітивний розвиток, МРТ була нормальною. Очні знахідки включали косоокість, катаракту, короткозорість або зниження гостроти зору. Нестабільна хода та напади були у деяких, але не у всіх постраждалих людей.
У двох додаткових сім'ях із, мабуть, несиндромною X-пов'язаною розумовою відсталістю були виявлені нові мутаційні помилки в екзонах 8 і 27 гена CASK (Hackett et al., 2010). Таким чином, фенотипи, пов’язані з мутаціями CASK, варіюються від легкої затримки розвитку, з вродженим ністагмом або без нього, до важких когнітивних порушень, пов’язаних з гіпоплазією мозочка та понтину та аномаліями розвитку кори.
Муг та співавт. (2011) виявили 20 пацієнтів жіночої статі з варіаціями кількості субмікроскопічних копій, включаючи дев'ять делецій та дві дублікації, що охоплюють CASK та різні інактивуючі мутації гена, та розглянули фенотиповий спектр, пов'язаний із мутацією втрати функції CASK.
Burglen та співавт. (2012) виявили мутації, що інактивують CASK, у двох хлопчиків (один з них - мозаїка) та восьми дівчат з понтоцеребелярною гіпоплазією, психомоторною відсталістю, важкою інтелектуальною недостатністю, прогресуючою мікроцефалією, дистонією, легким дисморфізмом та сколіозом. Часто асоціювались інші ознаки: затримка росту, офтальмологічні аномалії (глаукома, мегалокорнея та атрофія зорового нерва), глухота та епілепсія. У 3 додаткових пацієнток жінки були виявлені субмікроскопічні делеції Xp11.4, включаючи ген CASK.
Муг та співавт. (2015) виявив мутації CASK у 8 пацієнтів чоловічої статі, включаючи одну нісенітницю, одну делецію 5-bp, одну мутацію стартового кодону та п’ять часткових делецій та дублювань генів; сім були de novo, включаючи три соматичні мозаїцизми. Запропонована фенотипова класифікація синдрому CASK: (1) MICPCH з важкою епілептичною енцефалопатією, спричиненою гемізиготними мутаціями втрати функції; (2) MICPCH, пов'язаний з інактивуючими змінами в мозаїчному стані або частково проникаючою мутацією; та (3) синдромна/несиндромна легка до важка інтелектуальна вада з ністагмом або без нього, спричинена помилковими помилками CASC та сплайсинг-мутаціями, які залишають білок CASK цілим, але, ймовірно, змінюють його функцію або зменшують кількість нормального білка.
Пресинаптичне регулювання ліпринами
К. Міллер, Д. Ван Вактор, в Енциклопедії неврології, 2009
Ліпрін-α та КАСК
CASK (CAKI або CAMGUK у мух) - це мембранно-асоційований білок, асоційований з гуанілаткіназою (MAGUK), який має каталітично неактивний N-кінцевий домен CaM-кінази, який взаємодіє з Veli і Mint-1, домен SH3, який пов'язує N-тип Канали Ca 2+ та центральний домен PDZ, який взаємодіє з іншими мембранними білками, такими як глікофорини, нейрексини та синдекан. Спостереження за взаємодією між CASK та синдеканом є особливо цікавим у світлі нещодавньої демонстрації того, що інший ліпрін-α-взаємодіючий білок, LAR, також зв'язується із синдеканом. Крім того, LAR і CASK зв'язують ліпрін-α в одній і тій же області (див Фігура 1 ). Ми піднімаємо ймовірність того, що взаємодія між цими трьома білками може мати значення для їх функції, але визначення того, як ці білки взаємодіють, потребуватиме подальшого дослідження.
Порушення caki призводить до збільшення спонтанного вивільнення нейромедіатора та порушення реакції гігантського волоконного шляху на безперервну стимуляцію. Ці дефекти, мабуть, включають втрату пресинаптичного контролю екзоцитозу, що схоже на дефект, який спостерігається у мутантів ліпрін-α. Дефект нейромедіації, який спостерігається у мутантів caki, є однією з багатьох можливостей пояснити, як порушення ліпріну-α призводить до дефектів нейромедіації.
Клітинна глікобіологія та розвиток; Здоров’я та хвороби в глікомедицині
4.17.3.5 Формування синапсів
Синдекан-2 специфічно локалізований в синапсах у зрілому мозку та в дендритних хребтах нейронів, що культивуються довго. 231 Цей PG може взаємодіяти з білками домену PDZ, включаючи постсинаптичний білок CASK/LIN-2 через його COOH-кінцевий тетрапептидний мотив EFYA, а синдекан-2 і CASK спільно локалізуються в синапсах. 232 Надмірна експресія синдекана-2 у короткочасно культивованих нейронах гіпокампа прискорює дозрівання дендритних колючок, але не впливає на кількість синапсів або шипів. 231 Навпаки, версикан, здається, бере участь у пресинаптичному дозріванні. В зоні тектуму зародка курчат версикан селективно експресується підмножинами інтернейронів, приурочених до пластинок ретинореципієнта, в яких аксони сітківки арборизуються і утворюють синапси. 233 In vitro версикан сприяє збільшенню пресинаптичних варикозних розширень в аксонах сітківки. Виснаження версикана in ovo за рахунок втручання РНК призводить до альтанок сітківки з меншими, ніж звичайні варикозними розширеннями, що вказує на те, що ця CSPG забезпечує специфічну для ламіна клітинку пресинаптичне дозрівання.
Нейролігіни та нейрексини
35.8.2 Біологічні механізми клітин функцій NRX та NL
Ліпрін-α та складання синаптичної цитоматриці ☆
Додаткові партнери Liprin-α
Взаємодія ліприну-α з досинаптичними білками
Структура пресинаптичного AZ складається з ядра з п’яти білків: Liprin-α, RIM, UNC-13/mUnc-13, RIM-BP та ELKS (з гомологами Rab6IP2, CAST, Brp та ERC). З них RIM та ELKS зв'язуються із спіралеподібною областю Liprin-α. У мишей RIM регулюють розмір пулу, що легко вивільняється, і важливі для регулювання ймовірності нормального вивільнення нейромедіатора, а також вивільнення під час короткочасної синаптичної пластичності. RIM також сприяє накопиченню кальцієвих каналів як у мишей, так і у дрозофіли. У C. elegans порушення як RIM, так і Liprin-α зменшує появу щільних проекцій на AZ, які, як вважають, відіграють певну роль у стикуванні SV з AZ. Крім того, Liprin-α ссавців регулює оборот RIM, а також асоційований з AZ білок CASK, пропонуючи один механізм, за допомогою якого Liprin-α може динамічно регулювати AZ.
Білки ELKS мають дуже специфічну локалізацію до AZ, необхідні для синаптичного розвитку та морфогенезу AZ, і були показані в Drosophila для контролю розміру легко вивільняється пулу SV. У C. elegans ізоформа ELKS/CAST2 потрібна для функції Liprin-α в синапсі; крім того, приріст функції Liprin-α у глистів збільшує набір цієї ізоформи ELKS до щільних проекцій. Крім того, вважається, що ізоформа ERC2/CAST1 у C. elegans модулює рівень Liprin-α.
Окрім взаємодії з основними AZ-білками, Liprin-α також взаємодіє з AZ-асоційованим білком GIT1, взаємодією G-білкових рецепторних кіназ. GIT1 відіграє роль у переробці СВ і спостерігається регулювання сили та ймовірності вивільнення нейромедіаторів. Більше того, взаємодія GIT1 та Liprin-α необхідна для внутрішньоклітинного обігу рецепторів AMPA. Спокусливо припустити, що одна і та ж взаємодія GIT1-Liprin-α може відігравати конкретну контекстну роль у торгівлі транс-Гольджі, аксональному транспорті, торгівлі дендритами та торгівлі SV.
Також спостерігалося, що ліпрін-α 1–4 є компонентом досинаптичного комплексу білків PDZ MALS/Veli-CASK-Mint-1, асоціації, яка виникає між доменами SAM ліпріну-α та N-кінцевим регіон КАСК. Порушення всіх трьох ізоформ MALS у мишей було смертельним протягом години після народження та порушило збудливу синаптичну передачу. Відповідно до дефектів передачі, нокаутовані миші MALS демонстрували виснаження у звільненому пулі СВ, можливо, через порушення поповнення пухирців із резервного пулу, що вказує на важливість комплексу MALS/Veli-CASK-Mint-1/Liprin-α.
Тендітний синдром X та інтелектуальна вада, пов’язана з X
107.3.7.4 Додаткові гени
CASK кодує кальцій-кальмодулінозалежну серинову протеїнкіназу. Спочатку мутації CASK описувались у дівчаток з важким ІД, мікроцефалією та гіпоплазією мозочка та хлопчика, який помер у віці 2 тижнів, що призвело до думки, що мутації CASK є домінуючими із зниженою життєздатністю у хлопчиків (165). Подальші дослідження показують, що це може бути правдою для серйозних мутацій з втратою функції в CASK, але що мутації зі зниженою функцією виявляються у хлопчиків з ІД. Тарпей та ін. (7) виявили мутації у хлопчиків із чотирьох із 358 сімей XLID (1,1%) у вибірці консорціуму GOLD. Вроджений ністагм був присутній у постраждалих осіб із двох вихідних сімей, що змусило дослідників згодом шукати мутації в CASK у 45 додаткових пробандах з ідентифікатором та ністагмом або мікроцефалією; 2 із 45 пробандів (4,4%) мали мутації в CASK (166). Таким чином, наявність ністагму у хлопчика з ІД може вважатися показником для аналізу послідовності CASK.
Консорціум GOLD також надав докази того, що CUL4B може бути важливою причиною XLID (167). Вони виявили мутації у 8 з 250 сімейств XLID (3%). CUL4B кодує убиквитин Е3-лігазу. На додаток до ІД, у хлопчиків з мутаціями спостерігається макроцефалія, низький зріст, судоми та агресивні спалахи (167) .
Ген IQSEC2 - ще один ген, ідентифікований шляхом екстенсивного секвенування в сімействах GOLD (168). У 208 сім'ях XLID (1,9%) було виявлено чотири помилкові мутації. Здається, мутації пов’язані із затримкою мови, судомами та аутичними ознаками.
Вперше було встановлено, що мутації OPHN1 спричиняють ідентифікацію у зразку EuroMRX. OPHN1 кодує олігофренін 1, активуючий Rho-GTPase-білок. Мутації були виявлені у пробандів із сімей, які вважають NS-XLID, але МРТ уражених осіб задокументували гіпоплазію мозочка та дисплазію вермісу (169). Це призвело до того, що Занні та ін. запропонувати використовувати нейрорадіологічне дослідження осіб з ІД для виявлення тонких аномалій мозку, які можуть бути використані для прямої молекулярної діагностики (169). У наборі EuroMRX три з 63 сімей з облігатними жіночими носіями (4,8%) мають мутації OPHN1, а аналогічна частка сімей із ураженими парами братів у їх вибірці (3 з 65; 4,6%) мають мутації цього гена (6 ) .
Мутації PQBP1 були виявлені як у синдромічній, так і в несиндромічній формі XLID. Це включає синдром Ренпеннінга, синдром XLID, який включає мікроцефалію, малі яєчка та низький зріст (170). Існує широкий клінічний спектр, пов’язаний з мутаціями PQBP1, і це також може включати вроджені вади серця та черепно-лицьові аномалії (171) та мікрофтальмію (172). З 111 сімей XLID з особами, які перебувають на облігації, у вибірці EuroMRX, де Брауер та ін. виявлено п’ять із мутаціями PQBP1 (4,5%); з іншого боку, не було виявлено мутацій у 73 сім'ях із ураженими парами братів або в 465 спорадичних випадках ІД серед чоловіків (6). Дослідження Jensen та співавт. знову виявили нижчу частоту мутацій (0,7%) у сім'ях з меншою кількістю уражених хлопчиків; у однієї із 135 сімей, у яких не було більше двох постраждалих братів, виявлено мутацію PQBP1 (160) .
Мутації у JARID1C спочатку були виявлені у 5 із 179 сімей з вибірки EuroMRX (2,8%) (173). Подальший аналіз 144 сімей NS-XLID, також зібраних за допомогою EuroMRX, виявив п'ять мутацій JARID1C, частота 3,5% (174). Ця частота не трималася у всіх зразках; Абіді та ін. виявили одну мутацію із 172 загальних пробандів XLID (0,6%) (175). Використання низького зросту як критерію відбору може збільшити цю частоту; В 1 із 92 пробандів з ідентифікатором та низьким зростом (1,6%) було виявлено мутацію JARID1C (175). Нарешті, 2 з 208 сімей XLID (1%) у зразку GOLD мали мутацію в JARID1C (176). Об'єднання даних усіх опублікованих осіб з мутацією JARID1C вказує на те, що вони мають ідентифікатор, який коливається від легкого до важкого, а також клінічну картину, яка може включати низький зріст, судоми, гіперрефлексію та мікроцефалію (176). Самки-носії можуть постраждати слабо.
SynCAM
Внутрішньоклітинна взаємодія білків SynCAM
Порівняно з позаклітинним аналізом зв'язування SynCAM, взаємодії цитоплазматичних доменів білків SynCAM менш добре охарактеризовані. Частково, розмитість послідовності взаємодії PDZ типу II, яку білки SynCAM мають на своїх крайніх С-кінцях, може опосередковувати взаємодії in vitro з низкою партнерів, які можуть виникати, а можуть і не відбуватися, або бути значущими in vivo. Дослідження за афінною хроматографією продемонстрували, що цитоплазматичний хвіст SynCAM 1 здатний взаємодіяти з експресованими в мозку молекулами-адапторами CASK, Mint1 та синтеніном, які є білками, що містять домен PDZ, і виявляються в різній мірі в центральних синапсах. Сигналізація SynCAM 1 у нервовій системі правдоподібно опосередковується за допомогою цих адаптерних білків, оскільки вони також синаптично збагачені. Цілком ймовірно, що ці партнери по взаємодії SynCAM 1 також зв'язують цитоплазматичні послідовності інших членів сімейства SynCAM, але це ще потрібно підтвердити. Як очікувалось, SynCAM 1 не взаємодіє з білками, що містять домен PDZ типу I, такими як PSD-95. Крім того, SynCAM 1 не пов'язує нектин взаємодіючий білок афадин, що містить домен PDZ.
Взаємодія цитоплазматичних послідовностей SynCAM 1 також вивчалася поза ЦНС. SynCAM 1 взаємодіє з DAL1, членом сімейства білка 4.1, що експресується в легенях. Ця взаємодія була підтверджена як біохімічними, так і клітинними біологічними методами. Крім того, білок, що містить PDZ-домен, званий «білок, асоційований з Lin7–2», був ідентифікований з яєчок як білок, здатний взаємодіяти з SynCAM 1 на дріжджовому двогібридному екрані.
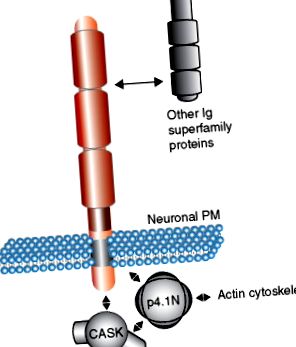
Подібність послідовностей цитоплазматичних доменів SynCAMs та нейрексинів ( Малюнок 1 (b) ) припускає, що вони функціонують, залучаючи подібні молекули адаптера на пресинаптичній стороні. SynCAM та нейрексини мають спільну послідовність взаємодії білка 4.1 та мотив взаємодії PDZ типу II. Слід зазначити, що білок 4.1 також здатний взаємодіяти з лісовою молекулою CASK, забезпечуючи потенційно бажане утворення тримерного комплексу SynCAMs, білка 4.1 та CASK ( Малюнок 2 ). Подібний комплекс був описаний для білків нейрексину. Таким чином, цитоплазматичні домени SynCAM можна уявити як багатовалентні ділянки нуклеації для будівельних лісів та цитоскелетних молекул, які в кластерах збирають молекулярні комплекси, такі як апарати для вивільнення везикул. Цей механізм кластеризації пропонує привабливу гіпотезу щодо того, як молекули клітинної адгезії опосередковують складання синаптичних мембранних комплексів.
Малюнок 2. Модель білково-білкової взаємодії сімейства молекули адгезії синаптичних клітин (SynCAM). SynCAM 1 взаємодіє з різними членами надсімейства імуноглобуліну (Ig) через свої позаклітинні домени. Внутрішньоклітинно SynCAM 1 взаємодіє з молекулами адаптерів, що містять домен PDZ, такими як CASK, і утворює тримерний комплекс з p4.1N, який може зароджувати цитоскелетні структури в синапсі. ПМ, плазматична мембрана.
- Бісквіт - огляд тем ScienceDirect
- Ацетон - огляд тем ScienceDirect
- Співвідношення ASTALT - огляд тем ScienceDirect
- Тушкування - огляд тем ScienceDirect
- Acanthosis Nigricans - огляд тем ScienceDirect