Бутират та пропіонат захищають від ожиріння, спричиненого дієтою, та регулюють гормони кишечника за допомогою незалежних механізмів вільного прийому жирних кислот 3
Хуа В. Лінь
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Андреа Фрассетто
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Едвард Дж. Ковалік-молодший
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Андреа Р. Навроцький
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Мофей М. Лу
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Дженніфер Р. Косінський
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Джеймс А. Губерт
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Дафна Сето
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Сяоруї Яо
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Гейл Форест
1 Діабет та фармакологія In vivo, дослідницькі лабораторії Merck, Рахуей, Нью-Джерсі, Сполучені Штати Америки,
Дональд Дж. Марш
2 Оцінка безпеки, дослідницькі лабораторії Merck, Вест-Пойнт, Пенсільванія, Сполучені Штати Америки,
Задумав та спроектував експерименти: HVL AF ARN DJM. Виконував експерименти: HVL AF EJK ARN MML JRK JAH DS XY. Проаналізовано дані: HVL AF EJK DS XY GF. Написав папір: HVL DJM.
Анотація
Вступ
Коротколанцюгові жирні кислоти (SCFA) виробляються мікробіотою в товстій кишці та дистальному відділі тонкої кишки із стійкого крохмалю, харчових волокон та інших малозасвоюваних полісахаридів у процесі бродіння [1]. Ацетат, пропіонат та бутират є переважаючими SCFA у просвіті кишечника у людей та гризунів і присутні на високих рівнях mM [2]. Отримавши SCFA, вони легко поглинаються колоноцитами. Бутират значною мірою використовується епітелієм товстої кишки як джерело енергії, а пропіонат - переважно у печінці, тоді як значна кількість ацетату надходить у системний кровообіг і досягає периферичних тканин. Окрім того, що SCFA діють як джерела енергії, вони також є сигнальними молекулами. Рецептори, зв’язані з G білками Рецептори вільних жирних кислот 2 (FFAR2, GPR43) та FFAR3 (GPR41) були визначені як ендогенні рецептори для SCFA. Ацетат переважно активує FFAR2 in vitro; пропіонат виявляє подібний агонізм на FFAR2 та FFAR3; а бутират переважно активує FFAR3 [3], [4].
У цьому дослідженні ми вивчаємо вплив SCFA на масу тіла, метаболізм глюкози та гормони кишечника у мишей дикого типу та нокауту Ffar3. Ми показуємо, що бутират та пропіонат пригнічують прийом їжі, захищають від індукованого дієтою збільшення жиру та непереносимості глюкози та стимулюють секрецію кишкового гормону переважно за допомогою механізмів, незалежних від FFAR3. Ми також показуємо, що FFAR3 не потрібен для нормальної маси тіла та гомеостазу глюкози.
Результати
SCFA пригнічують ожиріння, спричинене дієтою, за допомогою чітких механізмів
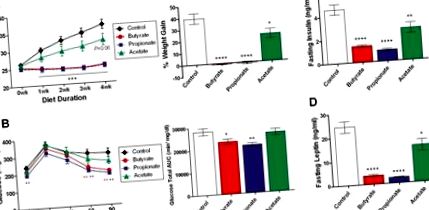
Тримісячних нежирних мишей C57BL/6N переводили на HFD, що містить солі натрію, що відповідають молярності, бутират (5% мас.), Пропіонат (4,3%) та ацетат (3,7%) протягом чотирьох тижнів. (А) Масу тіла вимірювали щотижня, а сукупний приріст ваги за чотири тижні виражали у відсотках від початкової маси тіла. (B) Пероральний тест на толерантність до глюкози проводили у мишей, що голодували протягом ночі, через чотири тижні після зміни дієти. Показані рівні глюкози в крові та загальна площа глюкози під кривою (AUC). (C, D) Рівень інсуліну та лептину у плазмі крові визначали у мишей, що голодували протягом ночі, через чотири тижні після зміни дієти. Дані є середніми ± SEM. N = 8. * P Малюнок 3A-C), а рівні обох гормонів нормалізувались до вихідного рівня через шістдесят хвилин після введення дози (дані не наведені). PYY також продемонстрував помірне збільшення через десять хвилин після перорального введення бутирату (Рисунок 3D). Ці зміни були пов'язані з підвищеним вмістом інсуліну та аміліну в плазмі крові (малюнок 3E, F) у мишей, які отримували бутират, що узгоджується зі стимуляцією β-клітин підшлункової залози інкретинами. Пропіонат натрію значно підвищував GIP, інсулін та амілін, але не GLP-1 або PYY. Домішка SCFA, що імітує ендогенні пропорції, присутні в товстій кишці (ацетат 260 мкг, пропіонат 80 мкг і бутират 60 мкг), також спричинила незначне збільшення GIP. На відміну від цього, жоден з досліджених гормонів не зазнав суттєвих змін ацетатом натрію, дозованим або в дозі 400 мг/кг (рисунок 3), або 300 мг/кг (молярність відповідає виклику бутирату натрію, дані не наведені). Крім того, середньоланцюгова жирна кислота октанова кислота (ОА) та довголанцюгова жирна кислота α-ліноленова кислота (ЛА) також не виявили значного ефекту. Варто зазначити, що порядок ранжування бутирату> пропіонату> ацетату при стимуляції анорексигенних пептидів GLP-1, PYY та аміліну узгоджується з їх впливом на інгібування прийому їжі, причому бутират є найбільш потужним (Малюнок 2А).
(AF) Тримісячні нежирні миші C57BL/6N голодували протягом ночі і дозували перорально фізіологічним розчином, бутиратом натрію, пропіонатом натрію, ацетатом натрію, домішкою SCFA (65% ацетату натрію, 20% пропіонату натрію, 15% бутирата натрію), октанова кислота (OA) або α-ліноленова кислота (LA), все при 400 мг/кг маси тіла. Рівні загального GLP-1, активного GLP-1, GIP, PYY, інсуліну та аміліну в плазмі вимірювали через 10 хвилин після введення. CV% внутрішньо аналізу був нижче 8,9% для всіх імуноаналізів. Дані є середніми ± SEM. N = 8. * P Малюнок 4A). Потім мишей переводили на HFD з добавкою бутирату та пропіонату протягом восьми днів. Як бутират, так і пропіонат пригнічували набір ваги та споживання їжі у нокаутах Ffar3 в тій же мірі, що і у мишей дикого типу (Малюнок 4B-D). Цікаво, що хоча нокаути Ffar3 на контрольному HFD не показали різниці у масі тіла порівняно з однолітками дикого типу, вони продемонстрували помірне збільшення споживання їжі на 9% (малюнок 4E), що узгоджується зі зниженою ефективністю збору енергії з дієти, про яку повідомляється в окремому нокауті Ffar3 рядок [11].
(А) Вага тіла тримісячних нокаутів Ffar3 та однолітніх диких типів на стандартній дієті чау та через тиждень після переходу на HFD. N = 34–41. (B-D) Після тижневого годування HFD нокаути Ffar3 та одноплідники дикого типу були переведені на HFD, що містить бутират натрію (5%) або пропіонат натрію (4,3%) протягом восьми днів. Показана кумулятивна зміна маси тіла та щоденне споживання їжі. Дані є середніми ± SEM. N = 8–13. * P Малюнок 5А). Ця схема експресії відповідає потенційній ролі в секреції пептидів з L, K та інших ентероендокринних клітин. Нокаути Ffar3 продемонстрували нормальний загальний та активний рівні GLP-1 натще, але загальна секреція GLP-1, викликана бутиратом, послаблювалась за відсутності FFAR3 (рис. 5B, C). Рівні GIP у нокаутах Ffar3 виявилися нижчими, ніж у контролів дикого типу, в умовах, стимульованих базальним та бутиратом, але ступінь стимуляції бутиратом була однаковою між генотипами, а рівень пропіонату демонстрував незначне збільшення нокаутів (рис. 5D, Е). Стимуляція PYY та інсуліну бутиратом була притуплена в цій когорті, ймовірно, через вплив HFD протягом чотирьох тижнів, і не показала значної різниці між генотипами (рисунок 5F, G). Ці дані свідчать про те, що стимуляція бутирату секреції GLP-1 з L-клітин частково опосередковується FFAR3, тоді як стимулюючі ефекти бутирату та пропіонату на секрецію GIP із клітин K не залежать від FFAR3. Цікаво, що бутират значно знизив рівень греліну в плазмі крові у нокаутах Ffar3, тоді як цей ефект не досяг статистичної значущості у контрольних мишей (Малюнок 5Н).
(А) Склад тіла визначали кількісним ЯМР у нокаутах Ffar3 та однолітках дикого типу після п’яти місяців годівлі HFD. (B, C) Рівні лептину в плазмі крові визначали у нокаутах Ffar3, що голодувались на ніч, та у однолітках дикого типу, що підтримувались на стандартній дієті чау чи HFD. (D) Глюкозу в крові вимірювали у мишей, що годували ad libitum, які підтримували HFD через три години після початку світлової фази. (E) пероральний тест на толерантність до глюкози після нічного голодування та (F) внутрішньоочеревинний тест на толерантність до інсуліну після п’ятигодинного денного голодування при нокаутах Ffar3 та однолітках дикого типу, що підтримуються на HFD. Дані є середніми ± SEM. N = 8–14.
Обговорення
Повідомлялося, що рівень SCFA у просвіті кишечника досягає високих рівнів mM в товстій кишці людини та свиней, але значно нижчий у товстій кишці та клубовій кишці [21]. У поточному дослідженні обрані дози SCFA були у високому діапазоні мМ, ймовірно, досягаючи супрафізіологічних рівнів in vivo, особливо в проксимальній кишці. Таким чином, вплив на кишкові гормони може не відображати фізіологічну дію SCFA, але свідчить про потенційну користь від фармакологічного лікування SCFA. Перорально введені SCFA можуть, швидше за все, досягти проксимального відділу тонкої кишки протягом 10 хвилин - ранній час, вибраний для гострих досліджень, оскільки спорожнення шлунка рідкого болюсу у мишей відбувається дуже швидко і може перевищувати 80% протягом 15 хвилин [22]. Однак малоймовірно, що пероральний болюс SCFA досягне дистального відділу тонкої кишки та товстої кишки протягом 10 хвилин. Отже, вплив на GLP-1 та GIP може відображати пряму стимуляцію ентероендокринних клітин у проксимальній частині тонкої кишки, де можуть бути знайдені як L-клітини, так і K-клітини. З іншого боку, L-клітини, що експресують PYY, присутні лише в товстій кишці та дистальному відділі тонкої кишки, що свідчить про непрямий спосіб дії бутирату на цей гормон кишечника.
Залежне від бутирату та пропіонату інгібування прийому їжі та збільшення ваги було незмінним у нокаутованих мишей Ffar3, що вказувало на інші ендогенні медіатори у цих ефектах. Варто зазначити, що нокаути Ffar3 на контрольному ВЧД показали помірну гіперфагію, але мали нормальну масу тіла та ожиріння. Це узгоджується з попередньою доповіддю, що показує прискорений кишковий транзит та посилене виведення калової енергії в незалежну лінію нокауту Ffar3 [11], припускаючи, що FFAR3 необхідний для нормальної перистальтики кишечника та поглинання поживних речовин. Механізми, що відповідають за збільшення споживання їжі та нормалізацію маси тіла за відсутності FFAR3, невідомі. Показано, що SCFA регулюють секрецію лептину з жирової тканини. Однак роль FFAR3 у опосередкуванні цих ефектів залишається суперечливою [23], [24]. Ми показали, що нокаути Ffar3 підтримують нормальний рівень лептину в плазмі, припускаючи, що лептин не відіграє великої ролі в нормалізації енергетичного гомеостазу в нокаутах Ffar3. Нещодавно повідомлялося, що у нокаутованих мишей Ffar3 знижений пульс у спокої та симпатична активність [19]. Однак цей ефект, як очікується, зменшить витрати енергії і не може пояснити зниження ефективності подачі нокаутів Ffar3.
Гострі виклики та дослідження харчових добавок
Бутират натрію, пропіонат натрію, ацетат натрію, октанова кислота та α-ліноленова кислота були отримані від Sigma-Aldrich (Сент-Луїс, Міссурі). Для гострих досліджень мишей голодували протягом ночі та дозували перорально. при 6 мл/кг із сполуками, розчиненими у фізіологічному розчині. Для досліджень дієтичних добавок солі натрію SCFA у твердому вигляді ретельно змішували у дієту з високим вмістом жиру за допомогою кухонного комбайна при 300–400 об/хв, формували у кулі по 50–60 г і негайно використовували. Контрольна дієта аналогічно оброблялася без додавання SCFA. У дослідженнях довше 10 днів свіжа дієта складалася і поповнювалась щотижня. Для гострих досліджень на нокаутованих мишах Ffar3 та однолітках однотипних тварин ту саму когорту, яка використовувалася для 8-денного дослідження дієтичних добавок, повертали до нормального рівня HFD протягом 3 тижнів, потім повторно рандомізували та використовували для експериментів з гострим бутиратом/пропіонатом через обмежена доступність тварин. Величина стимуляції активного GLP-1 та GIP бутиратом була однаковою між мишами дикого типу на звичайній дієті чау та тими, які отримували HFD 4wk.
Вимірювання плазми
Кров відбирали через серцеву пункцію або піднижньощелепні кровотечі в пробірки EDTA, що містять інгібітор DPP4 (Millipore, Billerica, MA) та коктейль з інгібітором протеази (Sigma-Aldrich). Загальний GLP-1 та активний GLP-1 вимірювали за допомогою імуноаналізів Meso Scale Discovery (Гейтерсбург, MD). Загальний GIP, активний PYY, інсулін, амілін, лептин та загальний грелін вимірювали за допомогою панелі гормонів кишечника Milliplex (Millipore).
Метаболічні аналізи
Тест на толерантність до глюкози (3 г/кг перорально) проводили після нічного голодування у мишей C57BL/6N, яких годували HFD, доповненим SCFA, протягом чотирьох тижнів, а також у п’яти-шестимісячних Ffar3 -/- та диких типів послідівників що годували HFD протягом шести тижнів. Тест на толерантність до інсуліну (0,75 Од/кг внутрішньовенно) був проведений у шести- до семимісячного Ffar3 -/- та однолітніх дитинчат на HFD протягом десяти тижнів після 5-годинного видалення їжі щодня. Глюкозу вимірювали з хвоста крові за допомогою вимірювача OneTouch Ultra (LifeScan, Milpitas, CA). Склад тіла визначали за допомогою ЯМР Bruker minispec (Bruker Optics, Billerica, CA) у восьмимісячних Ffar3 -/- та однолітніх диких типів, яких годували HFD протягом двадцяти тижнів. Рухову активність вимірювали за допомогою комплексної лабораторної системи моніторингу тварин (Columbus Instruments, Columbus, OH), як описано раніше [31].
Статистичний аналіз
Дані аналізували за допомогою t-критерію Стьюдента або одностороннього ANOVA з пост-тестом Бонферроні. Значення Р менше 0,05 вважали значущими.
Подяка
Ми дякуємо А. Покай, Д.Е. Келлі, М. Трухільо та інші колеги з дослідницьких лабораторій Мерка за корисну дискусію та критичне читання рукопису.
Виноски
Конкуруючі інтереси: Усі автори - співробітники дослідницьких лабораторій Merck, штат Рахуей. Немає заявлених патентів, продуктів, що розробляються, або продуктів, що продаються. Це не змінює дотримання авторами всіх політик PLoS ONE щодо обміну даними та матеріалами.
Фінансування: Автори не мають підтримки чи фінансування для звітування.
- Бутират, але не пропіонат, зменшує дефіцит нейрокогнітивних функцій у потомства, викликаний материнською дієтою
- Анотація P436 Роль вільних жирних кислот у пацієнтів з ожирінням та серцевою недостатністю
- Біоматеріали, що регулюють травлення жиру для лікування ожиріння - ScienceDirect
- Оцінка щурів із ожирінням, спричинених дієтою, як моделі ожиріння шляхом порівняльної функціональної геноміки -
- Стаття про ожиріння буйволів від The Free Dictionary