Мультимодальні біологічно сумісні наночастинки паладію, покриті олігосахаридом хитозану, що наводяться до пухлини, для фотозйомки та терапії
Предмети
Анотація
Паладій, плазмонічний інфрачервоний матеріал, визнаний своїм використанням у фототермічній терапії як альтернатива наноматеріалам золота. Однак його потенційне застосування недостатньо вивчено в біомедичних цілях. У цьому дослідженні були синтезовані наночастинки паладію, і поверхня частинок була успішно модифікована олігосахаридом хітозану (COS), що покращило біосумісність частинок. Що ще важливіше, частинки були функціоналізовані пептидом RGD, який покращує накопичення частинок у клітинах раку молочної залози MDA-MB-231 та призводить до посилених фототермічних терапевтичних ефектів під 808-нм лазером. Наночастинки паладію, пов’язані з пептидом RGD, покриті COS (Pd @ COS-RGD), мають хорошу біосумісність, дисперсність води, колоїдну та фізіологічну стабільність. Вони ефективно руйнують пухлину при лазерному освітленні 808 нм при щільності потужності 2 Вт см-2. Крім того, Pd @ COS-RGD дає хорошу амплітуду фотоакустичних сигналів, що полегшує візуалізацію тканин пухлини за допомогою неінвазивної системи фотоакустичної томографії. Нарешті, виготовлений Pd @ COS-RGD діє як ідеальний нанотерастичний засіб для посиленої візуалізації та терапії пухлин за допомогою неінвазивного ближнього інфрачервоного лазера.
Вступ
Нецільові тераностичні засоби знижують терапевтичну ефективність за рахунок неспецифічного накопичення в інших тканинах. Існує два можливі механізми поліпшення вибірковості пухлин щодо наночастинок: (i) пасивне націлювання завдяки посиленому збереженню проникності та (ii) активне націлювання на основі специфічного рецептора клітинної поверхні з лігандом на наночастинках 17. Інтегрини, гетеродимерні білки адгезії клітин, що беруть участь у багатьох механізмах, включаючи прикріплення клітин, ангіогенез та метастазування твердих пухлин, були визначені для активного націлювання пухлинної тканини на клінічних слідах 18. Серед різних типів інтегрину інтеграни alphaV beta3 (αvβ3) визнані перспективними терапевтичними мішенями, оскільки вони надмірно експресуються під час проліферації пухлинних клітин 19. У цій роботі ми функціоналізували Pd NP з мотивом RGD (аргінін-гліцин-аспарагінова кислота), який може зв'язуватися з αvβ3 інтегринами на поверхні клітини і, можливо, збільшити самонаведення фототерапевтичного агента до ділянки пухлини.
Хитозан - це природний, біологічно розкладається, нетоксичний, катіонний вуглеводний полімер, який широко використовується у фармацевтиці, косметиці та харчовій промисловості 20. Хітозан значною мірою отримують з хітину оболонки ракоподібних, і він складається з β-1,4-пов'язаного d -глюкозаміну. У своїй природній формі хітозан має низьку розчинність у безкислотному водному середовищі, що обмежило його застосування у фармацевтичній галузі. В останні роки інтенсивні дослідження призвели до розробки з хітозану олігосахариду хітозану (COS) з низькою молекулярною масою та водорозчинним. Завдяки своїм унікальним властивостям COS став прекрасним кандидатом для різних біомедичних застосувань, включаючи доставку ліків, доставку генів та тканинну інженерію 21. У даній роботі поверхня NP Pd була модифікована COS-полімером (Pd @ COS NPs), що забезпечує біосумісність та забезпечує подальшу функціоналізацію з іншими цікавими молекулами за допомогою звичайної хімії сполучення з використанням амінових та гідроксильних груп.
Рак молочної залози, один із найпоширеніших видів раку серед жінок, призводить до смерті у всьому світі через терапевтичну стійкість до традиційної хіміотерапії 22. Потрійний негативний рак молочної залози (ТНБК) - це підвид раку молочної залози, який характеризується негативною експресією прогестерону, естрогену та рецептора 2 епідермального фактора росту і може агресивно метастазувати 23. TNBC становить 10–15% випадків раку молочної залози, і пацієнти з цим підтипом раку мають погані результати при клінічній хіміотерапії. Клітинна лінія TNBC MDA-MB-231, яка була охарактеризована для позитивної експресії інтегрину αvβ3 24, яка була обрана як модельна клітинна лінія для вивчення цільової здатності кон'югованих з пептидом RGD НП у цьому дослідженні.
У цій роботі ми синтезували біосумісні НР Pd з покриттям COS і функціоналізували їх пептидом RGD (Pd @ COS-RGD) для ефективного накопичення в клітинах раку молочної залози. Крім того, з використанням досліджували фототермічну абляцію на основі NIR та ефективність візуалізації PAT сформульованих частинок в пробірці і в природних умовах моделі.
Результати і обговорення
Система наночастинок
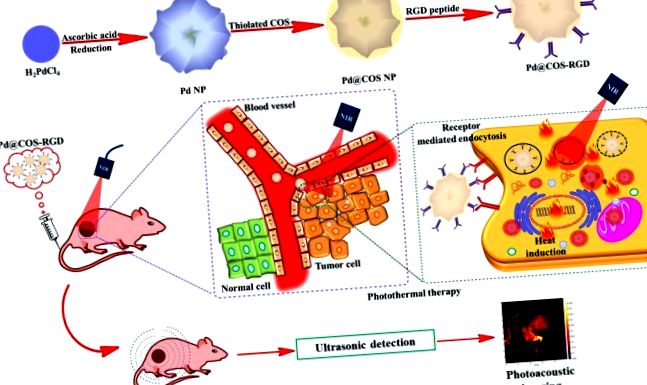
Наноструктури паладію були визнані в біомедичних полях своїми чудовими оптичними та каталітичними властивостями. Потужна підготовка NP Pd та поетапна модифікація поверхні пептидом COS та RGD показані на рис. 1а та рис. S1. Спочатку тиольований COS наносили на поверхню NP Pd за допомогою підходів обміну лігандами для отримання NP Pd @ COS. По-друге, ангідрид малеїну кон'югувався на поверхню NP Pd @ COS за допомогою реакції розкриття кільця. Малеїнові ангідридні групи можуть реагувати з гідроксильними (-ОН) та вторинними аміно (-NH) групами, присутніми в полімерних одиницях COS, утворюючи “ен” -групи (Pd @ COS-COOH NPs). Нарешті, циклічні пептидні одиниці RGD були успішно кон'юговані на NP Pd @ COS-COOH за допомогою «хімії тиол-ен-кліку» шляхом реакції між тіоловими групами пептиду RGD та «ен» частиною Pd @ COS-COOH NP для отримання Pd @ COS-RGD, що є кінцевим продуктом (рис. S1). Осередковане рецепторами накопичення Pd @ COS-RGD в клітинах пухлини та їх дворежимне застосування для візуалізації PTT та PAT показано на рис. 1b.
(a) Схема, що демонструє підготовку NP Pd та подальше покриття поверхні покритим олігосахаридом хітозану (NP Pd @ COS) і, нарешті, функціоналізацію з використанням пептиду RGD (Pd @ COS-RGD). (b) Систематична ілюстрація, що демонструє фототермічну абляцію та фотоакустичне зображення пухлинної тканини за допомогою Pd @ COS-RGD.
Характеристика наночастинок
У цьому дослідженні пористі НП Pd синтезували, дотримуючись протоколу росту, опосередкованого насінням, у водному розчині з хлоридом цетилтриметиламмонію (CTAC) як стабілізуючим агентом, як описано Вангом та ін. 25. Спектр поглинання Pd NPs, який спостерігається від UV-Vis до NIR-області (рис. 2а), що кваліфікує Pd NP як потенційний фототермічний агент із використанням NIR-лазера. Малюнок 2b показує, що розмір НП Pd був відносно однорідним, із сферичною формою, схожою на квітку, що містить пористі структури. Розподіл за розмірами синтезованих NP Pd впав між 18 і 26 нм, із середнім розміром 22,26 ± 0,97 нм (рис. S2a). Аналіз вибраної області дифракції електронів (SAED) показує кристалічну природу синтезованих частинок (рис. 2б). Решітчасті бахроми, виявлені на малюнку SAED [(111), (200), (220) та (311)], виявляють кристалічні площини Pd NP. Крім того, рентгенівська картина синтезованих НЧ Pd показує піки при 40,1 °, 46,5 ° та 68,3 °, які відповідають (111), (200) та (311) кристалічним площинам (рис. 2в), що підтримують кристалічна природа NP Pd (JCPDS No 46–1043). Пікова інтенсивність при 40,1 ° (111) була найбільш інтенсивною порівняно з іншими піками відбиття, які можуть відображати бажаний напрямок росту нанокристалів 26 .
(a) Ультрафіолетовий спектр поглинання НЧ Pd, Pd @ COS NP і Pd @ COS-RGD, дисперговані у воді. (b) TEM-зображення Pd NP з різними модифікаціями, а також шаблонами SAED. (c) Картини рентгенівської дифракції (XRD) в діапазоні 2θ 20–80 ° початкових НЧ Pd та кінцевих Pd @ COS-RGD. (d) Спектр FTIR ліофілізованих НЧ Pd, Pd @ COS NP і Pd @ COS-RGD.
Модифікація поверхні NP Pd з COS
NP Pd @ COS-RGD демонстрували чудову довготривалу стабільність у водних середовищах принаймні протягом 6 місяців. Під час тривалого зберігання у воді не спостерігалось суттєвих змін у положенні поверхневої плазмонової смуги (рис. S3a). Це показало, що Pd @ COS-RGD був стабільним, і у водному розчині не було виявлено агрегації. Агрегація частинок призводить до зв’язаних плазмонових смуг на довших довжинах хвиль 31; однак цих смуг не спостерігалося (рис. S3a). Розмір частинок залишався незмінним, і при тривалому зберіганні в дистильованій воді флокуляції не спостерігалось (рис. S3b). Pd @ COS-RGD мав добру колоїдну стабільність у різних фізіологічних розчинах (рис. S3c), що узгоджується з повідомленнями про те, що модифікації COS мають колоїдну стабільність 32 .
Термогравіметричний аналіз проводили для скринінгу покриття полімерних ланок COS та подальшого кон'югування пептидних ланок RGD на Pd NP. Як показано на рис. S3d, усі зразки демонструють початкову втрату ваги приблизно
6,2 мас.% При температурах 100–170 ° C за рахунок фізично всмоктуваного розчинника або вологи. Крім того, друга втрата ваги близько
16,5 мас.% Для NP Pd вказує на розкладання CTAC, присутнього на NP Pd (рис. S3d). На противагу цьому, покриті COS НП Pd @ COS та інші, пов'язані з пептидом RGD НП Pd @ COS-RGD, демонструють колективну втрату ваги приблизно
38 мас.% У діапазоні температур від 180 до 460 ° C, що вказує на те, що поверхня NP Pd була покрита полімером COS (рис. S3d). Чим далі
Втрата 8 мас.% Pd @ COS-RGD вказувала на розкладання кон'югованого з пептидом RGD полімеру COS (рис. S3d). Термогравіметричні дані показали, що значна кількість пептидних одиниць COS та RGD була включена в Pd @ COS-RGD.
Фототермічний ефект нагрівання
(a) Крива нагрівання Pd @ COS-RGD (50 ppm), диспергована в 1 мл води і опромінена лазером 808 нм при різних щільностях потужності. (b) Теплові криві Pd @ COS-RGD при різних концентраціях при лазерному освітленні 808 нм при щільності потужності 2 Вт см −2. (c) Теплова стабільність Pd @ COS-RGD (50 ppm) протягом 5 циклів експерименту ввімкнення/вимкнення лазера при щільності потужності 2 Вт см −2. (d) Оптичний спектр поглинання Pd @ COS-RGD до і після 5 циклів експерименту ввімкнення/вимкнення лазера.
Для вивчення фотостабільності НЧ Pd використовувались експерименти лазерного ввімкнення/вимкнення. Водний розчин (1 мл), що містить 50 ppm (Pd) Pd NPs, опромінювали протягом 5 циклів експерименту включення/виключення живлення, використовуючи 808-нм лазер (2 Вт см −2). Для кожного циклу розчин опромінювали протягом 5 хв і давали розчину охолонути до кімнатної температури природним шляхом. Зміни температури, зафіксовані протягом усіх 5 циклів, представлені на рис. 3c. NP Pd демонстрували стабільну термічну стабільність, досягаючи 53 ° C через 5 хв лазерного опромінення для кожного повторного циклу. Спектр поглинання НЧ Pd вимірювали після експерименту ввімкнення/вимкнення лазера. Спектри розчинів NP Pd не виявили суттєвих відмінностей до та після опромінення (рис. 3d). Порівняно з наноструктурами золота та срібла, наноструктури Pd є найстабільнішими фототермічними перетворювачами 7 .
Ефективність фототермічного перетворення NP Pd порівнювали з нанотрупами Au, оскільки Au є стандартними NP NP еталонних металів. Оптична щільність як Pd NP, так і розчинів нанородів Au була відрегульована до 1,0 одиниці поглинання при 808 нм. Потім розчини опромінювали 808 нм лазером при щільності потужності 2 Вт см −2 протягом 5 хв і давали температурі охолоджуватися природним шляхом. Порівняльна теплова крива представлена на рис. S5. Як видно на рис. S5, теплові профілі Pd NPs та Au нанородів були цілком порівнянними. Хуанг та ін. повідомили, що нанолісти Pd служать ефективним фототермічним агентом з ефективністю теплового перетворення 93,4%, що порівнянно з нанородільниками Au 36. Загальновживані наночастинки металів, такі як залізо, золото, срібло та платина, були широко вивчені з різними модифікаціями поверхні, і деякі з них використовувались у клінічних випробуваннях 37. Кількість досліджень щодо використання НП Pd як терапевтичних засобів обмежена, і немає жодного дослідження щодо цільового накопичення НД Pd у тканинах пухлини.
Біосумісність НП
Посилене накопичення Pd @ COS-RGD
В пробірці фототермічна цитотоксичність
До в природних умовах У дослідженні фототермічний цитотоксичний ефект Pd @ COS-RGD оцінювали в клітинах MDA-MB-231 за допомогою стандартного аналізу МТТ. Спочатку фототермічну токсичність Pd @ COS-RGD в клітинах MDA-MB-231 оцінювали за допомогою лазера 808 нм при різних щільностях потужності. На малюнку 4С показано різке зниження життєздатності клітин залежно від щільності потужності лазера. Рівень смертності клітин був зафіксований як 22,24, 73,8 та 94,1% при 1, 2 та 3 Вт см −2 відповідно. У той же час у контрольних клітинах, оброблених при щільності потужності 3 Вт см-2, спостерігали 11,7% смертності клітин. Теплова ефективність НП Pd @ COS-RGD сильно варіювала в залежності від щільності потужності 808-нм лазера (рис. 4в). Крім того, загибель клітин була меншою при 1 Вт см −2 порівняно з 2 Вт см −2 при лікуванні НП. Оскільки температура досягала 41 ° C за 2 хв і зростала до 52 ° C за 5 хв (рис. 3а), спостерігалась значна загибель клітин (73,32%) при щільності потужності 2 Вт см −2. Щільність потужності 2 Вт см-2 була обрана оптимальною щільністю потужності для подальших експериментів. У цьому випадку різкої активації при загибелі клітин було досягнуто за рахунок підвищення температури вище 48 ° C протягом декількох хвилин під час лікування, і це вважалося ефективною та незворотною загибеллю клітин.
Індукована PTT апоптотична загибель клітин була додатково досліджена за допомогою проточної цитометрії через 8 годин лазерного лікування. Клітини, оброблені РТТ, подвійно фарбували FITC-Анексином V та PI, а потім проводили аналіз FACS. Результати показали, що значна частина опромінених лазером клітин Pd @ COS-RGD + зазнала раннього апоптозу (49,1%); одночасно деякі клітини прогресували до пізньої фази апоптозу/некрозу (12,5%) (рис. S8b). Ми визнали, що більшість клітин контрольної, лазерної контрольної та контрольної груп НП (близько 98,4, 92,7 та 95,2% відповідно) були побудовані в реальному стані (рис. S8b). Тому Pd @ COS-RGD завдав очевидних пошкоджень клітинам MDA-MB-231 при опроміненні лазерним світлом 808 нм при 2 Вт см −2. Загалом, результати в пробірці Дослідження показує, що Pd @ COS-RGD має великий потенціал для NIR-активованої фототермічної токсичності завдяки посиленому накопиченню в клітинах MDA-MB-231.
В природних умовах Біорозподіл
Досліджувати в природних умовах накопичення пухлини, Pd @ COS NP і Pd @ COS-RGD доставляли до миші, встановленої пухлиною MDA-MB-231, шляхом ін'єкції хвостової вени. Пухлину на мишах розтинали через 1, 12 та 24 год після ін'єкції частинок, а тканину пухлини лізували акварегією для вимірювання частинок Pd за допомогою аналізу ICP-MS. Малюнок 5а показує, що функціонований RGD Pd @ COS-RGD був розміщений у пухлині з високою частотою, ніж Pd @ COS NP, на всіх часових інтервалах. Більш висока швидкість накопичення сталася через 1 год після введення хвостової вени.
В природних умовах PTT
Інфрачервоний термограф оголених мишей, що несуть пухлину молочної залози MDA-MB-231, опромінених 808 нм лазером при 2 Вт см −2 через 1 год внутрішньовенного введення PBS та Pd @ COS-RGD.
- Наночастинки Fe (NH2-trz) 3 Br2⋅3 H2O (NH2-trz 2-Amino-1,2,4-триазол), отримані за допомогою зворотного
- Підборіддя для посилення імунітету, м'які капсули з хітозановим хітином для схуднення - Китайська детоксикація, суха
- Швидкий втрата жиру на животі Хітозан зупиняє всмоктування жиру - Naturalexis
- Оригінальний хітозан Natural Balance
- Наночастинки плюс стовбурові клітини дорослих руйнують наліт, дослідження виявили - ScienceDaily