Більш високий відсоток жиру в організмі пов’язаний із посиленим сприйняттям температури при НАЖХП: результати рандомізованої Вессекської оцінки жирових печінкових та серцево-судинних маркерів при НАЖХП із дослідженням OMacor thErapy (WELCOME)
Анотація
Цілі/гіпотеза
Ефект від n-3 лікування жирними кислотами щодо сприйняття температури як функції функції сенсорного нерва є невизначеним. У пацієнтів з безалкогольною жировою хворобою печінки (НАЖХП) як з діабетом 2 типу, так і без нього, ми: (1) перевірили, чи покращувалося 15–18-місячне лікування 4 г/день докозагексаєнової та ейкозапентаенової кислоти (DHA + EPA) (HPT) та порогові значення сприйняття температури холодної (CPT) та (2) досліджені фактори, пов’язані з HPT та CPT, у рандомізованому, подвійному сліпому, плацебо-контрольованому дослідженні.
Методи
Ефект від лікування (n = 44) на HPT, CPT та індекс сприйняття температури (TPI: різниця між HPT та CPT) вимірювали на великому пальці стопи у 90 осіб без нейропатії (діабет 2 типу; n = 30). Учасники були рандомізовані 1: 1, використовуючи послідовну нумерацію, працівниками, незалежними від дослідної групи. Усі учасники та всі члени дослідницької групи були засліплені перед груповим призначенням. Дані були зібрані в Центрі біомедичних досліджень Національного інституту досліджень здоров’я Саутгемптона. Ефекти лікування та незалежність асоціацій тестували за допомогою регресійного моделювання.
Результати
Середній вік ± SD становив 50,9 ± 10,6 років. У чоловіків (n = 53) та жінки (n = 37), HPT (° C) становили 46,1 ± 5,1 та 43,1 ± 6,4 (стор = 0,02), CPT (° C) становили 22,7 ± 3,4 та 24,5 ± 3,6 (стор = 0,07) і TPI (° C) становили 23,4 ± 7,4 та 18,7 ± 9,5 (стор = 0,008) відповідно. При однофакторному аналізі загальний відсоток жиру в організмі (виміряний за допомогою рентгенівської абсорбціометрії з подвійною енергією [DXA]) асоціювався з HPT (р = –0,36 стор = 0,001), CPT (р = 0,35 стор = 0,001) та TPI (р = 0,39 стор = 0,0001). У моделях регресії, скоригованих на багатоваріативні зміни, з урахуванням віку, статі та інших потенційних факторів, що змішують, лише відсоток жиру в організмі був незалежним чином пов'язаний з HPT, CPT або TPIстор = 0,006, стор = 0,006 і стор = 0,002 відповідно). Лікування DHA + EPA не змінило HPT, CPT або TPI (стор = 0,93, стор = 0,44 і стор = 0,67 відповідно). Не повідомлялося про важливі побічні ефекти та побічні ефекти.
Висновки/інтерпретація
Більш високий відсоток жиру в організмі пов'язаний із посиленим сприйняттям температури. Не було користі від лікування високими дозами n-3 жирні кислоти на порогах для виявлення гарячих або холодних подразників.
Судова реєстрація:
Фінансування:
Ця робота була підтримана Національним інститутом досліджень охорони здоров’я через грант НІПЛ із Саудгемптонського відділу біомедичних досліджень та стипендією навчальних досліджень у галузі охорони здоров’я, пов’язаною з діабетом, наданою KMcC (Diabetes UK. BDA 09/0003937).
Вступ
Невеликі нейропатії сенсорних нервових волокон (SFSN) породжують симптоми порушення нервової чутливості та невропатичного болю, що вражає понад 90% людей з діабетом 1 та 2 типу [1, 2] і є основними ініціюючими факторами для виразки стопи та нижчих відділів ампутація кінцівок у хворих на цукровий діабет [3]. Механізми, що лежать в основі SFSN та невропатичного болю, недостатньо вивчені, але можуть включати метаболічні фактори, такі як підвищений внутрішньоклітинний рівень глюкози як у судинній, так і в нервовій тканинах, що може призвести до посилення окисного стресу та/або порушення мікросудинної системи та зменшення нервового кровотоку [4, 5 ].
Кількісне сенсорне тестування (QST) є методом оцінки соматосенсорної нервової системи і регулярно застосовується в клінічній оцінці функції сенсорних нервових волокон великих і малих [6, 7]. Нещодавно ми показали, використовуючи QST функції великих мієлінованих нервів, що як старіння, так і показник мікросудинної реактивності були незалежно пов'язані зі зміненим порогом сприйняття вібрації (VPT) при 125 Гц у групі пацієнтів з високим ризиком без ознак явної периферичної нейропатії [8]. QST також використовувався для вивчення функціональних дефіцитів при невропатіях дрібних волокон, причому пороги сприйняття температури є одним із найбільш широко застосовуваних тестів [9-11]. Такі тести забезпечують непряму, але відтворювану оцінку функції малого нерва людини [12, 13].
На сьогоднішній день не існує лікувальних заходів, які запобігають або зворотню хворобливу діабетичну нейропатію. Судинорозширювальні спреї можуть поліпшити нервовий кровотік [14], а альфа-ліпоєва кислота [15] (оскільки сірковмісний продукт, отриманий з октанової кислоти з восьмивуглеродними атомами жирної кислоти), в клінічних випробуваннях полегшує помірне знеболення. менше побічних ефектів, ніж опіоїди та антидепресанти [16]. Лікування високими дозами довголанцюгових поліненасичених n-3 жирні кислоти, такі як ейкозапентаенова кислота (EPA, 20: 5 n-3) та докозагексаєнової кислоти (DHA, 22: 6 n-3) було показано, що покращує сприйняття вібрації та клінічні симптоми невропатії у хворих на цукровий діабет 2 типу [17] та покращує функцію ендотелію при дисліпідемії, чоловіків із зайвою вагою [18], а також пропонує нейропротекцію за рахунок посилення нервового кровотоку в експериментальному модель діабетичної нейропатії [19]. Однак користь довголанцюгова n-3 жирні кислоти у пацієнтів із ризиком, але без периферичної нейропатії, залишається невизначеним.
У заздалегідь визначеному піддослідженні Вессекської оцінки жирової печінки та серцево-судинних маркерів при НАЖХП із дослідженням терапії OMacor (WELCOME) (реєстраційний номер ClinicalTrial.gov NCT00760513) [20, 21] (рандомізоване подвійне сліпе плацебо-контрольоване випробування), ми протестували ефект лікування DHA + EPA (Omacor/Lovaza) на пороги сприйняття температури при гарячій та холодній температурі. Нашою загальною метою було перевірити гіпотезу, що найвища ліцензована доза DHA + EPA n-3 лікування жирними кислотами (4 г/день у вигляді етилових ефірів) протягом мінімум 15 місяців та максимум 18 місяців мали сприятливий вплив на функцію малих сенсорних нервів у пацієнтів з високим ризиком щодо нейропатії, які мали резистентність до інсуліну та неалкогольні жирні жири захворювання печінки (НАЖХП) (з діабетом 2 типу або без нього).
Методи
Вивчати дизайн
Учасники стали частиною дослідження WELCOME, і дослідження були схвалені місцевим комітетом з етики досліджень (REC: 08/H0502/165) [20, 21]. Для дослідження було залучено сто п’ять осіб (див. Електронний додатковий матеріал [ESM] Рис. 1 для діаграми сукупності та тестування впливу втручання на цю вторинну кінцеву точку). Учасники були виключені з поточного аналізу, якщо у них були докази дистальної периферичної нейропатії в стопах, як припускає їх неможливість виявити 10 г мононитки [22] (n = 4), або якщо вони мали дані про діабетичну хворобу очей при скринінгу сітківки (n = 0). Теплові пороги вихідного рівня та кінця дослідження були отримані у 90 осіб (53 чоловіки та 37 жінок; середній вік 50,9 ± 10,6 років), з яких 44 були на активному лікуванні та 46 на плацебо. Учасники дали свою поінформовану письмову згоду. Біохімічні та антропометричні вимірювання були описані раніше [8].
Тестування периферичної неврологічної та мікросудинної функцій
Всі випробування проводились у приміщенні з контрольованою температурою (22–24 ° C), як описано раніше [8]. Учасники утримувались від кофеїнсодержащих напоїв, куріння та фізичних вправ протягом ≥2 год перед тестуванням. Вимірювання проводились на початковому етапі та в кінці дослідження.
Тестування сприйняття температури
Порогові значення сприйняття температури гарячої (HPT) та холодної (CPT) вимірювали на пульпі лівого великого пальця ноги за допомогою термоестезіометра (HVLab Diagnostics Instruments, Саутгемптон, Великобританія) [23] (детальніше див. Методи ESM). Для кожного індивідуума був побудований пороговий "індекс сприйняття температури" (TPI), розрахований як арифметична різниця між HPT та CPT (° C), виміряна на вихідному рівні [24].
Тестування на вібротактильне сприйняття
ВПТ при 125 Гц вимірювали на пульпі лівого великого пальця ноги, як було описано раніше [8] (детальніше див. Методи ESM).
Функція мікросудин
Шкірний мікросудинний кровотік оцінювали на вентральній поверхні недомінантного передпліччя за допомогою лазерної доплерівської флюксиметрії (MoorVMS LDF2, Moor Instruments, Axminster, UK) у стані спокою (РФ) та під час реакції дилататора на транзиторну ішемію (180 мм рт. Ст. Протягом 3 хв.); максимальний потік [MF]) [8] (докладніше див. Методи ESM).
Статистичний аналіз
Статистичний аналіз проводився за допомогою IBM SPSS Statistics 21.0 (IBM UK). Коефіцієнти рангової кореляції Пірсона та Спірмена використовувались для дослідження асоціацій між нормально та ненормально розподіленими змінними відповідно. У всіх випадках значення стор
Результати
Характеристика групи
У таблиці 1 наведено базові характеристики учасників без явної нейропатії або мікросудинних захворювань. З учасників 35 отримували лікування статинами, 32 - антигіпертензивними препаратами, сім - фібратами, 18 - інгібіторами АПФ (ACEI), 24 - метформіном та 13 - антидепресантами.
Ефект від n-3 втручання поліненасичених жирних кислот на порогах сприйняття температури
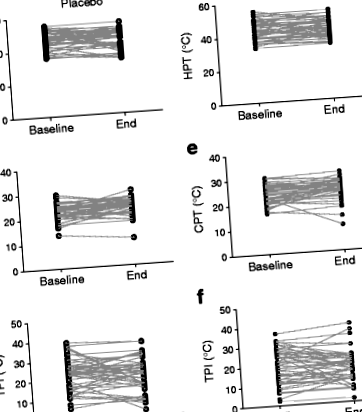
Індивідуальні вимірювання базового рівня та кінця дослідження для HPT, CPT та TPI для учасників наведені на рис. 1. У таблиці 2 представлені результати багатоваріантного регресійного моделювання, що перевіряє ефекти втручання DHA + EPA на зміну HPT, CPT та TPI ( тобто зміна між кінцем та початком дослідження) і не показує жодного впливу лікування на кожен з результатів, що цікавлять. Заміна HOMA-IR на статус діабету мало вплинула на моделі.
Вплив 15–18-місячного лікування DHA + EPA на HPT, CPT та TPI (різниця між HPT та CPT), виміряне на великому пальці ноги. (a-c) група плацебо; (d-f) група лікування
Зв'язок між HPT та CPT та факторами серцево-судинного та метаболічного ризиків на початковому рівні
Розсіяні графіки, що показують взаємозв'язок між (a) базові HPT та CPT та (b) TPI (різниця між HPT та CPT), виміряна на великому пальці ноги та загальний відсоток жиру в організмі, виміряний за допомогою DXA
Не було значущого зв’язку між HPT та CPT та показниками глікемічного статусу (концентрація глюкози натще або HbA1c, учасники з діабетом або без нього) або резистентності до інсуліну (HOMA-IR, учасники без діабету). У осіб з діабетом (n = 30), ГПТ була пов'язана з тривалістю діабету (р = 0,471, стор = 0,009), але CPT не був (р = −0,267, стор = 0,154).
HPT був пов'язаний з CPT (р = −0,670, стор Таблиця 3 Моделі багатоваріантної регресії з результатами HPT, CPT та TPI, а ключові коваріати та потенційні змішувачі як пояснювальні змінні
Обговорення
Наші нові результати не показують жодної користі від лікування DHA + EPA на порогах сприйняття гарячої або холодної температури у пацієнтів з НАЖХП як з діабетом, так і без нього. Ми вивчили ефекти найвищої ліцензованої дози n-3 жирні кислоти (4 г/добу, як Омакор/Ловаза) щодо показників функції малих сенсорних нервових волокон у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні, що триває мінімум 15 місяців та максимум 18 місяців у учасників, яким загрожує розвиток діабетику невропатія та невропатичний біль. Наскільки нам відомо, наше дослідження є першим рандомізованим подвійним сліпим плацебо-контрольованим дослідженням, яке вивчало вплив DHA + EPA на сприйняття температури. Ми також вперше показали, що теплові та холодні пороги теплового сприйняття були сильно та незалежно пов'язані із загальним відсотком жиру в організмі (але не з жиром у печінці або з контролем глікемії) у чоловіків та жінок.
Ми не виявили зв'язку між порогами сприйняття гарячої або холодної температури та показниками чутливості до інсуліну або HbA1c у цих пацієнтів, які мали ризик розвитку нейропатії. Наші висновки узгоджуються з результатами дослідження 156 осіб з периферичною нейропатією, де не було зв'язку між невропатією та глікемічним контролем [26]. Встановлено, що підвищені гарячі пороги є найбільш частим сенсорним дефіцитом у хворих на цукровий діабет, а гарячі пороги корелюють з глікемічним контролем у деяких [9, 27], але не у всіх [28, 29] дослідженнях. У тих, хто страждає на цукровий діабет, HPT був пов'язаний з тривалістю діабету, можливо, через підвищений окислювальний стрес, пошкодження нервів або зменшення щільності нервових волокон, що є ранніми явищами у людей з діабетом [30].
Сучасне дослідження розширює попередні дані, що дозволяють припустити, що функції як малих, так і великих сенсорних волокон порушені у неврологічно безсимптомних осіб як з діабетом, так і без нього. Порогові значення температурного сприйняття до гарячих та холодних подразників, пов'язані з активацією малих сенсорних аферентних A-дельта та C-нервових волокон, які ми вимірювали у великому пальці ноги, сильно корелювали з великим сенсорним нервовим волокном VPT, виміряним при 125 Гц [8]. Дисфункція великих волокон, виміряна за допомогою ВПТ, передбачає виразку стопи, ампутацію нижніх кінцівок та смертність [26]. Однак, наскільки оцінка функції дрібних клітковин за допомогою QST може представляти додатковий інструмент скринінгу для моніторингу прогресування захворювання та терапевтичного впливу, залишається невизначеним [34].
Обмеження
QST - це психофізичні тести, і їх використання як діагностичного інструменту як окремо, так і в поєднанні з іншими більш прямими тестами багато обговорюється [34]. Ми не можемо пропустити той факт, що існує ряд факторів, які можуть впливати на пороги сприйняття температури, які нам не вдалося виміряти, включаючи настороженість та увагу, інтеграцію сенсорної інформації від стимульованої ділянки шкіри та товщини шкіри [25]. Наші результати не давали жодних ознак покращення втручання (Таблиця 2). Ретроспективний розрахунок потужності на основі вибірки n = 90 с n = 44 у лікувальному плечі випробування показує, що ми мали 84% потужності для виявлення різниці температур у ВРТ на 3,5 ° C між вихідним рівнем та кінцем дослідження при лікуванні DHA + EPA. Те, що ми спостерігали лише 1 ° C середньої різниці температур у ВГТ між початковим рівнем та кінцем дослідження в плечі лікування, настійно припускає, що втручання не впливало на цю змінну, але нам знадобився б у десять разів більший обсяг вибірки, щоб довести ефекту від лікування не було. Крім того, з дуже низьким CV (
6%) від методів вимірювання порогу сприйняття температури, це дає нам подальшу впевненість у достовірності висновків. Цікаво відзначити, що в плані плацебо в дослідженні не спостерігалося погіршення порогів сприйняття температури. Цей висновок узгоджується як з результатами нашого попереднього дослідження, що вивчало вплив втручання DHA + EPA на ВПТ як показник функції великих сенсорних нервових волокон [8], так і з результатами інших [35]; і цілком ймовірно, що тривалість нашого випробування (мінімум 15 місяців та максимум 18 місяців) була недостатньою для того, щоб ми продемонстрували погіршення порогів сприйняття температури. Нарешті, ми не можемо бути впевнені у впливі тривалості діабету на сприйняття температури в нашій когорті, оскільки визначення дати початку діабету 2 типу часто є неточним у клінічній практиці.
Висновки
Таким чином, лікування найвищою ліцензованою дозою DHA + EPA (як Omacor/Lovaza) не змінило сприйняття температури, зумовлене дрібними нервовими волокнами, у пацієнтів з НАЖХП як з діабетом, так і без нього. У цій групі пацієнтів з високим ризиком, без доказів явної периферичної нейропатії, відсоток жиру в тілі був незалежним чином пов’язаний з HPT та CPT. І HPT, і CPT були більш тісно пов'язані з показником загальної жирності тіла, ніж з будь-якими метаболічними факторами ризику.
- Більш високий відсоток жиру в організмі пов'язаний з посиленням сприйняття температури при НАЖХП
- Як втратити відсоток жиру в організмі для жінок - втрата жиру з харчуванням
- Користь для здоров’я від обмеження калорій, пов’язана зі зниженням температури тіла
- Пов’язуючи обмеження калорій, температуру тіла та тривалість здоров’я
- Пов’язування обмеження калорій, температури тіла та тривалості здоров’я - ScienceDaily