Вітамін B12b посилює цитотоксичність діетилдітіокарбамату синергічно, викликаючи параптозоподібну смерть клітин гортані гортані людини
Вітамін B12b підсилює цитотоксичну дію DDC у субконфлюентних культурах пухлинних клітин. (a - d) Посилення цитотоксичного ефекту DDC на 25 мкМ B12b щодо клітин HT1080, HT29, HEp-2 та A431. (e) Залежність цитотоксичного ефекту комбінації 1 мМ DDC + 25 мкМ B12b від субконфлюентних культур клітин HEp-2 від часу впливу. Компоненти (B12b та DDC) додавали одночасно через 24 години після висіву клітин. Дія DDC + B12b була перервана заміною культурального середовища на нове середовище росту. Цитотоксичність оцінювали через 48 год після додавання DDC та B12b (див. Матеріали та методи). Інкубація з 1 мМ DDC (відкриті кола) та з DDC + B12b (заповнені кола). Дані є середніми ± s.e.m. з п’яти окремих експериментів.
Вакуолізація клітин HEp-2 на стадії ініціації смерті комбінацією 1 мМ DDC + 25 мкМ B12b. (a) Контроль (b) після 5 год-інкубації клітин з 1 мМ DDC; (c) та (d) після 3- та 5-годинних інкубацій з DDC + B12b. Стрілки вказують на вакуолі в клітинах, оброблених DDC + B12b. Фазово-контрастна мікроскопія. (a ’), (b’), (c ’) та (d’): вибрані області, збільшені у вставках (a), (b), (c) та (d).
Зміни ультраструктури клітин HEp-2, спричинені інкубацією протягом 4 год у культуральному середовищі, що містить 1 мМ DDC та 25 мкМ B12b. (а) Ультраструктура контрольної комірки. Виділені ділянки, збільшені у вставках a, b та c. Смуги шкали: 3 мкм в огляді, 1 мкм в а і b і 0,5 мкм в с. (b) Ультраструктура клітини з помірними змінами після інкубації. Смуги шкали: 2 мкм в огляді та 1 мкм послідовно. (c) Ультраструктура клітини з важкими змінами після інкубації. Для відмежування клітини від позаклітинного простору плазматична мембрана клітини позначається пунктиром. Смуги шкали: 2 мкм в огляді та 0,5 мкм у лівій вставці та послідовно. N, ядро; n, ядерце; ЕР, ендоплазматичний ретикулум; G, апарат Гольджі; м, мітохондрії; г, гранули глікогену; fl, вторинні лізосоми; afl, аутофаголізосоми; v, вакуолеподібні мішки ER.
Відсутність ознак апоптозу під час ініціювання загибелі клітин комбінацією 1 мМ DDC з 25 мкМ B12b. (а) Інгібування активності каспази-3 в клітинах HEp-2, інкубованих з DDC + B12b. Як позитивний контроль, рекомбінантний білок izTRAIL значно підвищував активність каспази 3. (b) Відсутність міжнуклеосомної фрагментації ДНК у клітинах HEp-2, оброблених комбінацією DDC + B12b. 1 - необроблені контрольні клітини; 2 — клітини через 24 год інкубації з комбінацією 1 мМ дитиотриетолу + 25 мкМ B12b, що викликає апоптоз [18] (позитивний контроль); 3 — клітини через 24 год інкубації з DDC + B12b; 4 — маркери молекулярної маси. (c) Інгібітор пан-каспази zVAD.fmk не захищав клітини від загибелі, викликаної комбінацією DDC + B12b. zVAD.fmk (50 мкМ) додавали до культурального середовища за 1,5 год до додавання DDC + B12b протягом 6 год, після чого середовище замінювали свіжим, а потім після культивування протягом 48 годин оцінювали цитотоксичність. Дані є середніми ± s.e.m. з трьох окремих експериментів.
Конфокальна мікроскопія зображень ER-опосередкованої вакуолізації клітин НЕр-2 (a - c) та A549 (d - f) після 6 годин інкубації з 1 мМ DDC + 25 мкМ B12b. (а), (г) контрольні клітини; (b), (e) клітини, інкубовані протягом 6 год з 1 мМ DDC; (c), (f) клітини інкубували протягом 6 годин з DDC + B12b. Фарбування H342 (1 мкг/мл), ER-Tracker Red (1 мкМ) та LysoTracker Green (0,2 мкМ).
Конфокальна мікроскопія зображень клітин HEp-2, забарвлених Mitotracker Green (0,2 мкМ), ER-трекер Red (1 мкМ) та H342 (1 мкг/мл). (а) контроль; (b) клітини після 5-годинної інкубації з 1 мМ DDC та (c) з 1 мМ DDC + 25 мкМ B12b. Мембрани вакуолей, що з'явилися в клітинах, були пофарбовані червоним ER-трекером, але не зеленим Mitotracker.
Збільшення концентрації внутрішньоклітинного Ca 2+ під час ініціювання загибелі клітин за рахунок комбінації 1 мМ DDC + 25 мкМ B12b та впливу інгібітора рецептора IP3 та хелатора позаклітинного кальцію на цитотоксичність комбінації. (a) та (b) FL1 флуоресценція клітин, забарвлених 5 мкМ Fluo-4AM після інкубації з DDC та B12b. (c) Вплив інгібітора рецептора IP3 та EGTA на ініціювання загибелі клітин комбінацією DDC + B12b та вакуолізацією клітин (d - i). Клітини інкубували в середовищі для росту протягом 90 хв з 20 мкМ 2-APB або з 2,5 мМ EGTA, потім додавали DDC + B12b, і після 6-годинної інкубації середовище замінювали свіжим середовищем для росту без добавок. Цитотоксичність оцінювали через 48 годин після лікування порівняно з контролем. *, p d), 2,5 мМ EGTA (e), 20 мкМ 2-APB (f); DDC + B12b (g), EGTA + DDC + B12b (h) та 2-APB + DDC + B12b (i). Стрілки позначають вакуолі.
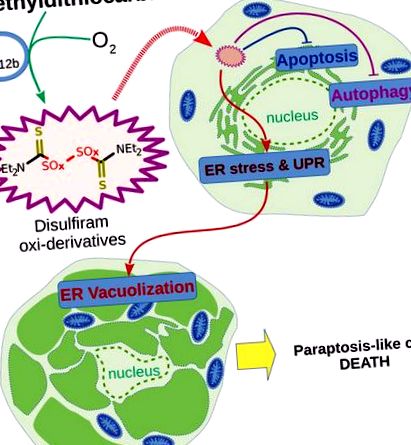
Гіпотетична схема внутрішньоклітинних подій під час ініціювання параптозоподібної загибелі клітин пухлини комбінацією DDC + B12b (детальніше див. Текст).
Анотація
Вітамін B12b підсилює цитотоксичну дію DDC у субконфлюентних культурах пухлинних клітин. (a - d) Посилення цитотоксичного ефекту DDC на 25 мкМ B12b щодо клітин HT1080, HT29, HEp-2 та A431. (e) Залежність цитотоксичного ефекту комбінації 1 мМ DDC + 25 мкМ B12b від субконфлюентних культур клітин HEp-2 від часу впливу. Компоненти (B12b та DDC) додавали одночасно через 24 години після висіву клітин. Дія DDC + B12b була перервана заміною культурального середовища на нове середовище росту. Цитотоксичність оцінювали через 48 год після додавання DDC та B12b (див. Матеріали та методи). Інкубація з 1 мМ DDC (відкриті кола) та з DDC + B12b (заповнені кола). Дані є середніми ± s.e.m. з п’яти окремих експериментів.
Вакуолізація клітин HEp-2 на стадії ініціації смерті комбінацією 1 мМ DDC + 25 мкМ B12b. (a) Контроль (b) після 5 год-інкубації клітин з 1 мМ DDC; (c) та (d) після 3- та 5-годинних інкубацій з DDC + B12b. Стрілки вказують на вакуолі в клітинах, оброблених DDC + B12b. Фазово-контрастна мікроскопія. (a ’), (b’), (c ’) та (d’): вибрані області, збільшені у вставках (a), (b), (c) та (d).
Зміни ультраструктури клітин HEp-2, спричинені інкубацією протягом 4 год у культуральному середовищі, що містить 1 мМ DDC та 25 мкМ B12b. (а) Ультраструктура контрольної комірки. Виділені ділянки, збільшені у вставках a, b та c. Смуги шкали: 3 мкм в огляді, 1 мкм в а і b і 0,5 мкм в с. (b) Ультраструктура клітини з помірними змінами після інкубації. Смуги шкали: 2 мкм в огляді та 1 мкм послідовно. (c) Ультраструктура клітини з важкими змінами після інкубації. Для відмежування клітини від позаклітинного простору плазматичну мембрану клітини позначають пунктиром. Смуги шкали: 2 мкм в огляді та 0,5 мкм у лівій вставці та послідовно. N, ядро; n, ядерце; ЕР, ендоплазматичний ретикулум; G, апарат Гольджі; м, мітохондрії; г, гранули глікогену; fl, вторинні лізосоми; afl, аутофаголізосоми; v, вакуолеподібні мішки ER.
Відсутність ознак апоптозу під час ініціювання загибелі клітин комбінацією 1 мМ DDC з 25 мкМ B12b. (а) Інгібування активності каспази-3 в клітинах HEp-2, інкубованих з DDC + B12b. Як позитивний контроль, рекомбінантний білок izTRAIL значно підвищував активність каспази 3. (b) Відсутність міжнуклеосомної фрагментації ДНК у клітинах HEp-2, оброблених комбінацією DDC + B12b. 1 - необроблені контрольні клітини; 2 — клітини через 24 год інкубації з комбінацією 1 мМ дитиотриетолу + 25 мкМ B12b, що викликає апоптоз [18] (позитивний контроль); 3 — клітини через 24 год інкубації з DDC + B12b; 4 — маркери молекулярної маси. (c) Інгібітор пан-каспази zVAD.fmk не захищав клітини від загибелі, викликаної комбінацією DDC + B12b. zVAD.fmk (50 мкМ) додавали до культурального середовища за 1,5 год до додавання DDC + B12b протягом 6 год, після чого середовище замінювали свіжим, а потім після культивування протягом 48 годин оцінювали цитотоксичність. Дані є середніми ± s.e.m. з трьох окремих експериментів.
Конфокальна мікроскопія зображень ER-опосередкованої вакуолізації клітин НЕр-2 (a - c) та A549 (d - f) через 6 годин інкубації з 1 мМ DDC + 25 мкМ B12b. (а), (г) контрольні клітини; (b), (e) клітини, інкубовані протягом 6 год з 1 мМ DDC; (c), (f) клітини інкубували протягом 6 годин з DDC + B12b. Фарбування H342 (1 мкг/мл), ER-Tracker Red (1 мкМ) та LysoTracker Green (0,2 мкМ).
Конфокальна мікроскопія зображень клітин HEp-2, забарвлених Mitotracker Green (0,2 мкМ), ER-трекер червоний (1 µM) та H342 (1 мкг/мл). (а) контроль; (b) клітини після 5-годинної інкубації з 1 мМ DDC та (c) з 1 мМ DDC + 25 мкМ B12b. Мембрани вакуолей, що з'явилися в клітинах, були пофарбовані червоним ER-трекером, але не зеленим Mitotracker.
Збільшення концентрації внутрішньоклітинного Ca 2+ під час ініціювання загибелі клітин за рахунок комбінації 1 мМ DDC + 25 мкМ B12b та впливу інгібітора рецептора IP3 та хелатора позаклітинного кальцію на цитотоксичність комбінації. (a) та (b) FL1 флуоресценція клітин, забарвлених 5 мкМ Fluo-4AM після інкубації з DDC та B12b. (c) Вплив інгібітора рецептора IP3 та EGTA на ініціювання загибелі клітин комбінацією DDC + B12b та вакуолізацією клітин (d - i). Клітини інкубували в середовищі для росту протягом 90 хв з 20 мкМ 2-APB або з 2,5 мМ EGTA, потім додавали DDC + B12b, і після 6-годинної інкубації середовище замінювали свіжим середовищем для росту без добавок. Цитотоксичність оцінювали через 48 годин після лікування порівняно з контролем. *, p d), 2,5 мМ EGTA (e), 20 мкМ 2-APB (f); DDC + B12b (g), EGTA + DDC + B12b (h) та 2-APB + DDC + B12b (i). Стрілки позначають вакуолі.
Гіпотетична схема внутрішньоклітинних подій під час ініціювання параптозоподібної загибелі клітин пухлини комбінацією DDC + B12b (детальніше див. Текст).
- BA покращує харчування під час польоту, повертає безкоштовні напої та закуски в умовах економії на короткі відстані
- Вимірювання ортотропної теплопровідності на комерційній тематиці
- Безкоштовний повнотекстовий аналіз рівня сприятливості агрономії клімату Севастопольської області для
- Безкоштовне повнотекстове обстеження поздовжньої точкової поширеності споживання антимікробних препаратів у
- Безкоштовна повнотекстова характеристика харчових розладів та впливу на хлорофіл та сільське господарство