BBS5 - огляд тем ScienceDirect
Завантажити у форматі PDF
Про цю сторінку
Пігментний ретиніт та розлади союзників
Кевін Грегорі-Еванс,. Річард Г. Велебер, у Сітківці (п’яте видання), 2013
Синдром Барде – Бідля та “BBSome”
Нещодавно було запропоновано, що багато білків, кодованих генами Барде-Бідля, утворюють комплекси, наприклад, BBS1, BBS2, BBS4, BBS5, BBS7, BBS8 і BBS9 - "BBSome". 520 Комплекс важливий у функціонуванні первинних війок, нерухливих проекцій, знайдених у численних типах клітин. Зокрема, вважається, що комплекси BBSome відіграють центральну роль у везикулярному обігу мембранних білків всередині війок. BBSome пов'язується з Rab8, фактором обміну GTP/ВВП, який бере участь у стикуванні та злитті везикул-носіїв родопсину в сполучній війці фоторецепторів. 521 Також відомо, що інші гени Барде-Бідля, наприклад, BBS3 (Arl6), утворюють функціональні зв'язки з цим BBSome. 522 Інші, здається, функціонують як шаперони, наприклад, BBs6, BBS10 та BBS12, а також в убіквітації білків (BBS11/TRIM32). 523
Рухливість та поведінка клітин
IX. Гени, пов’язані із захворюваннями людини
Синдром Барде-Бідля (BBS) - рідкісна аутосомно-рецесивна хвороба людини, яка вперше була визнана наприкінці 1800-х років. Це пов’язано із захворюваннями нирок, подібними нефронофтизу, центральному ожирінню, полідактилії, дегенерації сітківки, аносмії, гіпогеніталії та гіпертрофії серця. В даний час існує 13 генів, які були ідентифіковані у хворих на BBS людини. BBS6 є єдиним без чіткого гомолога у хламідомонаді. BBS5 був ідентифікований за допомогою збереження циліарних генів від людини до хламідомонади та відсутності цих генів у нерозщеплених організмах, таких як арабідопсис або дріжджі (рис. 2.6). Ген BBS5 був нанесений на карту в родині з Ньюфаундленду. Цікавий регіон становив 14 Мб і містив 230 генів. Лише два з 230 генів були присутні в порівняльній базі даних вій. Один із цих генів був невідомий і містив мутацію місця сплайсингу у постраждалих членів родини. Уражені члени трьох додаткових сімей з Кувейту несуть мутації, що призводять до передчасних стоп-кодонів цього гена (Li et al. 2004). Антитіла, вирощені до білка миші, виявляли локалізацію навколо базальних тіл у клітинах епендимальних мишей.
Виявлено, що DIP13/NA14 пов'язаний з базальними тілами та джгутиковими аксонемами, а також цитоплазматичними мікротрубочками (Pfannenschmid et al., 2003). Він взаємодіє зі спастином, який є ААА-АТФазою, що відіграє роль у розриві мікротрубочок (Errico et al., 2004). NA14 - це аутоантиген, асоційований із синдромом Шегрена, але немає жодних доказів того, що він причинно пов’язаний із захворюванням. Однак спастин асоціюється зі спадковою спастичною параплегією та дегенерацією аксонів (Ramos-Morales et al., 1998).
Інші білки, виявлені порівняльною геномікою, швидше за все, відіграють роль у джгутиках (див. Розділ 15). Сюди входять надсімейний білок Таббі (TUSP), фіброцистин, UNC119, який також відомий як HRG4, і морський коник та цилін, які, як було встановлено, спричиняють ембріональну летальність та кістозну хворобу нирок у даніо (Li et al., 2004).
Регулювання довжини циліуму та внутрішньочешковий транспорт
2.2.3 Синдром Барде – Бідля
Первинна війка
Луїс Ф. Менезес, Грегорі Г. Жерміно, у Методи в клітинній біології, 2009
II Первинні хвороби циліуму та кістозної нирки
Морфологічні докази
Перше спостереження, що свідчить про зв'язок між ПКР та війками, відбулося в результаті роботи в Caenorhabditis elegans, яка показала колокалізацію GOV-мічених LOV-1 та PKD-2 - гомологів PC1 та PC2 відповідно - у цитоплазмі та війці специфічних для чоловіків сенсорних нейронів. (Barr and Sternberg, 1999). Згодом клонування гена внутрішньо-жгутикового транспорту (IFT), IFT88, у хламідомонаді показало, що він гомологічний миші та людському Tg737, гену, який раніше був пов’язаний з кістозною хворобою нирок (Pazour et al., 2000). У Халамідомонаді для складання джгутиків необхідний IFT88; аналогічно, мутантні миші Ift88 Orpk/Orpk (Tg737) мають коротші первинні війки у збірних протоках у післяпологові дні 4 та 7 (Pazour et al., 2000). Попередні результати показали, що мутантні миші Tg737 мають ARPKD-подібний фенотип, спочатку з проксимальними канальцевими кістами з поступовим зсувом у бік переважно збираючого фенотипу кісти протоки та мальформації протоки пластинки в печінці (Moyer et al., 1994).
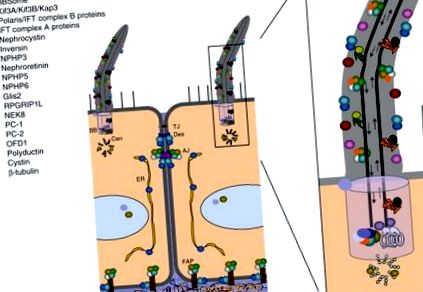
Тепер було встановлено сцену, щоб поставити цю раніше незрозумілу органелу в центр досліджень ПКД. Підштовхнуті цими результатами, ряд досліджень локалізував різні цистопротеїни на війках (рис. 2). PC2 був виявлений у війках як дикого типу, так і у мутантних мишей Tg737 (Pazour et al., 2002). PC1, PC2, polaris (білок, кодований Tg737), і цистин (білок, кодований геном, мутованим у мишей cpk, інша модель ARPKD-подібної миші (Hou et al., 2002)) були колокалізовані в віях збірного протоку миші клітинні лінії (Yoder et al., 2002), а полідуктин/фіброцистин також був знайдений у первинних війках (Gallagher et al., 2008; Kaimori et al., 2007; Menezes et al., 2004; Wang et al., 2004; Ward et al., 2003; Zhang et al., 2004). У дрозофіли РС2 локалізований на дистальному кінчику хвоста сперми (Watnick et al., 2003).
Рис.2. Підклітинна локалізація цистопротеїдів. Понад 20 цистопротеїнів були локалізовані в первинному комплексі циліум/базальне тіло (легенда вгорі ліворуч), але багато з них також відображаються в інших внутрішньоклітинних доменах. AJ, дотримується перехрестя; ВВ, базальне тіло; Цен, центріоль; ЕР, ендоплазматичний ретикулум; FAP, вогнищевий адгезійний наліт; TJ, щільне з'єднання. Адаптовано за матеріалами Watnick and Germino (2003). (Див. Табличку № 20 у розділі кольорової пластини.)
Сучасно з цими дослідженнями, також було показано, що білки BBS колокалізуються в структурах, асоційованих з віями. Мічений Myc BBS8 був локалізований в базальному тілі в клітинних лініях і в миготливих нейронах у C. elegans, де він має такий самий розподіл, як і гомологи BBS1, BBS2, BBS7 та IFT88 (Ansley et al., 2003). Згодом порівняльні геномічні підходи до ідентифікації бічків джгутикових і базальних тіл виділили BBS5 і показали, що він експресується виключно в основі війок у C. elegans (Li et al., 2004). Крім того, було показано, що BBS1, BBS2, BBS4, BBS5, BBS7, BBS8 і BBS9 утворюють стійкий комплекс BBSome, який локалізується в центросомі або базальному тілі (Nachury et al., 2007).
Здається, білки NPHP також присутні в війках. Після досліджень імунодетекції, які показали, що NPHP2/інверсин та NPHP1 колокалізувались з пунктиром у циліальній аксонемі (Otto et al., 2003), NPHP4 спостерігався у миготливих нейронах у C. elegans (Wolf et al., 2005); NPHP5 у війках клітин епітеліального канальця нирок (Otto et al., 2005); NPHP6 у центросомах (Sayer et al., 2006); GLIS2 в ядрах та інфузорій аксонеми (Attanasio et al., 2007); RPGRIP1L у центросомах, колокалізований NPHP4 (Delous et al., 2007); та NEK8 у проксимальній області війок (Mahjoub et al., 2005). Милостиня1 також була виявлена у війках (Hearn et al., 2005).
Б Функціональні докази
Перші функціональні докази, що пов'язують первинну війку з кістозною хворобою, були отримані у згаданих дослідженнях на мишах Tg737. Лінія мишей ORPKD, яка має гіпоморфний алель локусу Tg737, що утворюється шляхом випадкової вставки трансгену в локус, має морфологічно аномальні війки, аномалії печінки та кістозну хворобу нирок, дуже подібні до тих, що спостерігаються у ARPKD людини (Moyer et al., 1994). Повна інактивація локусу (Tg737 Δ2–3β-Gal) призводить до ще більш важкого фенотипу. У мутантних ембріонів розвиваються аномалії лівої/правої осі та клітини вентральних вузлів без центральної війки (Murcia et al., 2000). Подібні висновки були описані для мишачих моделей NPHP2. Мутант миші inv є результатом випадкової вставки трансгену в локус inv (Nphp2). У гомозигот розвиваються великі кістозні нирки та сітус-інверсус (Mochizuki et al., 1998; Morgan et al., 1998). Цікаво, що вії мутантних мишей, здається, мають нормальну морфологію, що припускає, що абсолютно нормально з'являються війки можуть, тим не менше, мати змінену циліарну функцію (Phillips et al., 2004). Це має значення для ряду інших кістозних моделей, де циліарна структура також є нормальною на світловому мікроскопічному рівні.
Додаткові докази випливають із результатів вставки скринінгу мутагенезу у даніо. Ембріони даніо - це прозорі тварини з простими пронефричними нирками, що складаються з двох клубочків, зрощених по середній лінії, кожен з яких з’єднаний з пронефричною протокою. Пронефричні нирки також можуть розвивати кісти і були використані як модель для розуміння ХХН (Drummond et al., 1998). На екрані було виявлено 15 локусів, які при мутації викликали пронефричні кісти (Sun et al., 2004). З десяти ідентифікованих генів додатково досліджено вісім, які показали, що п’ять брали участь у формуванні та роботі вій, три були гомологами компонентів ІФТ, а один був пов’язаний з відсутністю вій у пронефричних протоках.
Дослідження моделі умовного нокауту миші Kif3A (Lin et al., 2003) також вказують на те, що кістозна хвороба може бути наслідком порушення функції війки. KIF3A утворює гетеротримерний кинезиновий руховий комплекс KIF3 з KIF3B і KAP3, і, як вважають, він опосередковує спрямований на кінець мікронатрубки транспорт білкових комплексів і мембранно-зв’язаних везикул, а також збірки вій (Hirokawa, 2000). Після умовної інактивації Kif3A дистальних канальців у мутантних мишей спостерігалося прогресуюче утворення кісти нирки, маючи кілька кістозних сегментів у постнатальний день (Р5) (приблизно через 10 днів після інактивації), але масивне збільшення нирок і дифузне ураження дистальних канальців при Р35. Формування кісти супроводжувалося втратою первинних війок та підвищенням рівня ядерного β-катеніну, маркера підвищеної канонічної активності Wnt, в кістозному епітелії (Lin et al., 2003). Відповідно до цього висновку було встановлено, що зародки Kif3a -/- збільшували канонічну активність Wnt за допомогою репортерської лінії BAT-gal (Corbit et al., 2008). Оскільки нерегульована передача сигналів Wnt раніше вважалася можливою причиною кістозної хвороби нирок, ці дослідження припускають можливий механізм, що пов'язує циліарну дисфункцію з утворенням ниркової кісти. Ця тема обговорюється далі.
Незважаючи на цікаву кореляцію зі складанням вій, важливо зазначити, що багато білків, асоційованих з кістозною хворобою, виконують багато функцій всередині клітини і локалізуються в ряді різних субклітинних компартментів. Множинність функцій окремих білків у клітинах, які цілком можуть бути взаємозалежними, ускладнює приписування конкретних наслідків циліарної локалізації білка (Corbit et al., 2008). Наприклад, KIF3 опосередковує транспорт мікротрубочок всередині клітини не лише до первинної війки. PC2, здається, є інтегральним білком ендоплазматичного ретикулуму (ER), де він може функціонувати як канал вивільнення кальцію, і, як повідомляється, нефроцистин-1 утворює комплекс з Pyk2, p130 (Cas) і тензином у клітинному матриксі спайки на базолатеральній мембрані (Benzing et al., 2001; Koulen et al., 2002). Цікаво, що умовна інактивація KAP3 призводить до захоплення N-кадгерину в Гольджі, зменшення пулу меж клітин N-кадгерину і, як наслідок, збільшення цитоплазматичного β-катеніну (Teng et al., 2005). Ці дані підказують запитати, чи наслідки порушення роботи KIF3A є головним чином наслідком циліарної дисфункції або втрати інших функцій.
Мутанти IFT забезпечують найбільш вагомі докази, що пов'язують циліарну функцію різних цистогенів з кістозним фенотипом. В даний час вважається, що білки IFT функціонують виключно у формі циліарного утворення та функціонування. Якщо майбутні дослідження пропонують додаткові ролі для цього класу білків, можуть знадобитися додаткові стратегії для розрізнення їх циліарних та нециліарних властивостей та їх зв’язку з кістозною хворобою.
Нещодавнє дослідження одного з генів, виявлених на екрані даніо, може бути особливо інформативним. Мутанти морського коника дуже схожі на мутанти IFT з аномаліями осі L/R, зміненою кривизною тіла та пронефричними кістами (Kishimoto et al., 2008). Цікаво, що мутантні пронефричні кістозні епітеліальні клітини мають нормальну циліарну структуру, довжину та рухливість. Здається, білок присутній виключно в цитоплазмі, де він утворює комплекс з розпатланим. Розпатланий є ключовим компонентом системи сигналізації Wnt, відіграючи важливу роль як у канонічному, так і в неканонічному/планарному полярності комірок (PCP). Ці дослідження дозволяють припустити, що морський коник може функціонувати нижче за течією первинної війки, слугуючи сполучною ланкою між нею та шляхом Wnt. Ряд цистопротеїнів може подібним чином служити або для трансдукції циліарних сигналів, або для функціонування в ефекторних шляхах.
Гени та механізми в кіліопатіях людини
165.2.3 Розлади, схожі на кіліопатію
165.2.3.1 Синдром Барде – Бідля
Синдром Барде – Бідля (BBS) діагностується за допомогою поєднання основних та другорядних ознак. Основними критеріями є дистрофія палички-конуса, полідактилія, ожиріння (як правило, тулубне), труднощі з навчанням, гіпогеніталізм у чоловіків та аномалії нирок. Клінічний діагноз BBS приймається лише в тому випадку, якщо пацієнт має чотири основні критерії або три основні критерії та два або більше вторинних критеріїв. Вторинними ознаками є розлад мови, брахідактилія/синдактилія, затримка розвитку, полідіпсія/поліурія, атаксія, цукровий діабет, аномальні дефекти зубних рядів/піднебінних вроджених захворювань серця та фіброз печінки (109, 110). Причинні мутації виявлені в 17 різних генах BBS. Багато кодованих білків нехарактеризовані біохімічно і визначаються структурними доменами, які вони містять, такими як тетратрикопептидні повтори (BBS8) та тристоронні мотиви (BBS11). Підмножина цих білків (BBS1/2/3/4/5/7/8/9 разом із BBIP10, PCM-1 та RAB8a) утворює білковий комплекс, відомий як BBSome (обговорено далі) (111–114). BBS3/ARL6 - це невелика ГТФаза, яка бере участь у торгівлі везикулами до вій, тоді як BBS6, 10 і 12 є членами надсімейства шаперонінів типу II, які також утворюють комплекс (25, 26, 115) .
Кілька рядків доказів свідчать про те, що багато білків BBS функціонують всередині базального тіла. По-перше, порівняльний аналіз протеомів двох віддалено споріднених миготливих організмів, Homo sapiens та C. rheinhardtii, виявив 668 білків, які були спільними для цих видів, але яких не було в немиттєвій рослині Arabidopsis thalania, тим самим визначаючи базальне тіло джгутикового апарату (FABB). ) протеом. Білки BBS були значно збагачені протеомом FABB, а гени BBS транскрипційно регулювались після дефлагеляції C. rheinhardtii (31). Цей аналіз у поєднанні з даними про генетичні зв'язки служив для ідентифікації мутацій BBS5. По-друге, всі Са. geni elegans bbs експресуються виключно у війчастих нейронах, де вони регулюють IFT (116, 117). Нарешті, також було показано, що кілька білків BBS локалізуються в центросомах та базальних тілах клітин і тканин ссавців (26, 30111118), а підмножина білків BBS фізично взаємодіє, утворюючи так званий BBSome, який регулює транспорт везикул до війок (111 –114) .
165.2.3.2 Порушення спектру Меккеля – Жубера
165.2.3.3 Короткоребристі полідактилії та пов’язані з ними розлади
165.2.3.4 Первинна циліарна дискінезія
Як зазначено в таблиці 165-2, пацієнти з PCD страждають на хронічні рецидивуючі інфекції дихальних шляхів, спричинені невдалим мукоциліарним кліренсом. Інші супутні ознаки включають бронхоектатичну хворобу, синусит та пневмонію. Дефекти латеральності також часто зустрічаються у хворих на ПКД, включаючи сітус-інверсус (відомий як синдром Картагенера), солітус ситуса, декстрокардію та поліспленію, що можна пояснити вимогою до рухливих війок для формування спрямованого потоку рідини всередині ембріонального вузла (див. Далі) . Нарешті, чоловіки часто безплідні через порушення функції джгутиків сперми. Підсумовуючи, PCD представляє окремий клас рухомих циліопатій, який визначається ультраструктурними дефектами інфузорій, і підкреслює фізіологічне значення та розвиток рухомості вій.
- Бігуаніди - огляд тем ScienceDirect
- Похідна бігуаніду - огляд тем ScienceDirect
- Штучні дієти - огляд тем ScienceDirect
- Постійна асоціація - огляд тем ScienceDirect
- CD-1 Mouse - огляд тем ScienceDirect