Деривітизація амінокислот за допомогою вод AccQ • Хімія тегів
Аналіз амінокислот за допомогою рідинної хроматографії та оптичного виявлення вимагає додаткової підготовки зразків, оскільки більшість амінокислот не мають хромофору і їх неможливо виявити. Таким чином, після гідролізу наступним етапом аналізу амінокислот є дериватизація. Цей розділ описує підготовку білків або пептидних гідролізатів до дериватизації за допомогою Waters AccQ • Tag chemistry.
Для правильної та надійної дериватизації гідролізованого зразка необхідно враховувати наступне:
- Видалення твердих частинок
- Визначення маси зразка для дериватизації
- Визначення того, чи потрібна нейтралізація зразка
- Використання надлишку реагенту для дериватизації на основі маси зразка
Наступні обговорення скорочуються з необхідності. Для отримання додаткової інформації та вказівок щодо хімії дериватизації тегів відвідайте веб-сайт www.waters.com/AAA.
Центрифугування може знадобитися, якщо є велика кількість твердих частинок або плаваючих ліпідів. Центрифугування полегшує виведення аликвоти прозорого гідролізату для дериватизації.
Для зразків великого обсягу, таких як гідролізати аналізу корму, може бути достатньою фільтрація частинок, зазначаючи, що на вилучення зразків може вплинути вибір фільтруючого матеріалу. Цей фактор потрібно враховувати та розглядати, щоб отримати неупереджені результати. Зверніться до виробника фільтрів для отримання детальної інформації щодо продуктивності фільтрів у цій програмі.
Метод AccQ • Tag - це метод дериватизації перед колоною для амінокислотного аналізу гідролізованого пептиду та білків. Метод AccQ • Tag забезпечує наступне:
- Використовує Waters AccQ • Tag Ultra або AccQ • Реагент Fluor ™ для дериватизації амінокислот
- Відокремлює похідні за допомогою градієнтно-оберненофазної ВЕРХ або UPLC
- Точне кількісне визначення похідних за допомогою зовнішніх амінокислотних стандартів та оптичного детектування
Реагент 6-амінохіноліл-N-гідроксисукцинімідилкарбамату (AQC) реагує як з первинними, так і з вторинними амінами. Надлишок реагенту AQC реагує з водою з утворенням 6-амінохіноліну (AMQ). AMQ повільно реагує з надлишком реагенту AQC, утворюючи бісечовину. Ці побічні продукти не заважають розділенню, ідентифікації та кількісному визначенню амінокислот, що містяться в пептиді або білкових гідролізатах. Похідні стабільні протягом днів, дозволяючи пакетну обробку або повторний аналіз, якщо потрібно.
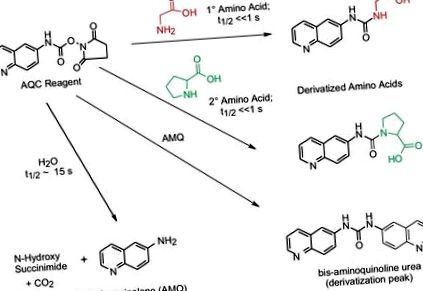
Протягом багатьох років проводились великі дослідження з метою забезпечення точності реакції виведення мітки AccQ. Сама хімічна реакція вимагає як молярного надлишку реагенту для дериватизації, так і основного рН (8–10) для повної дериватизації всіх амінокислот. Для вирішення цих критичних факторів були розроблені стратегії.
6.3.1 Визначення кількості зразка для AccQ • Дериватизація мітки
В самій реакції зразок, як правило, розбавляють 10 разів, і на колонку вводять 1 мкл із загального обсягу дериватизації 100 мкл. Оскільки при дериватизації не всі амінокислоти присутні в однаковій кількості, кількість зразка повинна бути достатньою, щоб найменш поширена амінокислота впливала на межу виявлення або кількісного визначення. Для отримання точного визначення кількості рекомендується дериватизація щонайменше 1 пмоль найменш поширеної амінокислоти в максимальному об'ємі ін'єкції 1 мкл. Щоб визначити кількість необхідної проби, виконайте наступний розрахунок:
➢ Приклад розрахунку:
Для концентрації зразка 1,0 мг/мл білка:
Оцініть кількість зразка, необхідного для найменш поширеної амінокислоти. У цьому прикладі ми вважаємо, що для доставки 1 пмоль на колонку цієї амінокислоти потрібно 0,03 мг/мл.
Крок 1: Визначте приблизну молярну концентрацію найменш поширеної амінокислоти.
Перетворення мг в моль (середня молекулярна маса амінокислотного залишку в білку становить 110).
Це розрахункова концентрація найменш поширеної амінокислоти в цій пробі.
Крок 2: Визначте розведення, необхідне для отримання 1 пмоль цієї найменш поширеної амінокислоти на колонці.
Це дає 27-кратне розведення (10 ÷ 0,37 = 27).
Гідролізат вимагає 27-кратного розведення перед дериватизацією. Наприклад: 5 мкл зразка гідролізату можна розбавити 135 мкл 0,1 н. HCl, щоб отримати це цільове значення.
Нарешті, аликвоту 10 мкл зазначеного вище розведення можна перенести у флакон з дериватизацією.
6.3.2 Нейтралізація для AccQ • Похідна мітка
Щоб забезпечити повну AccQ • Дериватизація реагентом міток амінокислот, що містяться в гідролізаті, зразок повинен бути забуферований в приблизному діапазоні рН від 8,2 до 10,1. Якщо гідролізат кислоти не буде нейтралізований належним чином, і якщо рН опуститься нижче 8,2, дериватизація буде неповною. Вплив рН змінюється для кожної амінокислоти. Зверніть увагу, що не всі амінокислоти впливають однаково. Кислі амінокислоти, такі як глутамінова кислота та аланін, впливають більше, ніж серин або фенілаланін. рН є критичним фактором для отримання точного визначення всіх амінокислот у вихідному зразку.
- Якщо розчин амінокислоти розчинений у 0.1N HCl, 10–20 мкл зразка можна перекласти безпосередньо в коктейль для дериватизації без регулювання рН. Noте:Це все-таки необхідно, щоб забезпечити, щоб доступний дериваційний реагент був надлишковим, як описано нижче.
- Якщо розчин амінокислоти знаходиться у більш високій концентрації кислоти (> 0,1 Н HCl), його слід нейтралізувати рівним об'ємом гідроксиду натрію при тій же концентрації. Це може бути зроблено як додавання основного обсягу, або інтегровано на етапі дериватизації.
- Замініть необхідну кількість боратного буфера NaOH, щоб нейтралізувати HCl у зразку.
- У суміш для флаконів з реакцією дериватизації помістіть 10 мкл xM NaOH та 60 мкл борату. Додайте 10 мкл зразка АА (у xN HCl). Дериватизують за допомогою 20 мкл AccQ • Фторового реагенту.
- Якщо є питання про належну нейтралізацію, ви можете підготувати пробні зразки та перевірити кінцевий рН одноразовими смужками рН.
WAЗВІНАННЯ: Якщо зразок стає яскраво-жовтим після додавання реагенту для дериватизації, рН зразка занадто низький. Нейтралізують NaOH.
➢ Приклад розрахунку:
Щоб визначити кількість NaOH, необхідну для нейтралізації, виконайте наступний розрахунок.
Для вищезазначеного зразка білка при 1,0 мг/мл у 6 N HCl, який потрібно розвести 27 разів, щоб забезпечити достатню кількість надлишку реагенту для дериватизації у зразку, застосовуються наступні розрахунки.
Крок 1: Розрахуйте кінцеву концентрацію кислоти у зразку після розведення.
Перетворіть концентрацію кислоти у зразку з молярної в мкмоль:
Визначте кінцеву концентрацію кислоти в розведеному зразку:
Нагадування: 5 мкл гідролізату зразка можна розбавити 135 мкл 0,1 N HCl, щоб отримати це цільове значення.
Крок 2: Визначте кількість основи (NaOH), яку слід додати до буфера для дериватизації.
Загальна кількість NaOH, необхідна для дериватизації, становить 0,31 М.
Оскільки загальний боратний буфер, доданий до дериватизації, становить 70 мкл, існує два методи нейтралізації:
Додайте 10 мкл 0,31 М NaOH і 60 мкл буфера для кожної дериватизації.
В окремому флаконі змішайте 600 мкл боратного буфера і 100 мкл 0,31 М NaOH. Змішати. Додайте 70 мкл цієї суміші + 10 мкл зразка + 20 мкл AccQ • Реагент для дериватизації міток для кожної проби.
6.3.3 Підтвердження надлишку реагенту дериватизації для AccQ • Дериватизація міток
Для повної дериватизації всіх амінокислот у реакції необхідний 4–6-кратний молярний надлишок реагенту AccQ • Tag для дериватизації. Якщо реагенту недостатньо, деякі відносно чутливі амінокислоти не будуть повністю дериватизовані. Швидкості дериватизації для кожної амінокислоти змінюються залежно від хімічних властивостей амінокислот; наприклад, на відновлення аланіну може суттєво вплинути недостатній молярний надлишок AccQ • Tag, тоді як фенілаланін більш захищений від цих ефектів.
Щоб визначити кількість зразка, яку слід додати до флакона з реагентом, нам потрібно знати кількість реагенту в кожному флаконі. Стандартний флакон з реактивом AccQ • Tag містить 3–4 мг реагенту, що становить приблизно 10–14 мкмоль реагенту. Оскільки реагент розчиняють в 1 мл ацетонітрилу, і 20 мкл використовують для кожної реакції дериватизації 100 мкл, кожен реакційний посудину містить 210–280 нмольs реагенту дериватизації.
Оскільки кожен флакон з реакцією містить 210–280 нмоль реагенту, і нам потрібно 4–6-кратний молярний надлишок для кожного зразка, у кожній реакції повинно бути не менше 40–140 нмоль загальних амінів.
➢ Приклад розрахунку:
Для зразка білка використовуйте масу зразка та середню масу амінокислоти, щоб оцінити необхідний надлишок.
Крок 1: Перетворіть концентрацію запасу в мг/мл на молярну концентрацію амінокислот.
Наприклад, при концентрації білка 1 мг/мл та середній молекулярній масі 110 кількість білка у зразку визначається наступним чином:
де МВт перетворюється в одиниці від г/моль до мкг/мкмоль, і
1 ммоль = 103 мкмоль = 106 нмоль
Крок 2: Визначте молярну кількість амінокислот у кожній реакції.
Після визначення молярної концентрації обчислюється кількість амінокислот у зразку.
Використовуючи білок 1 мг/мл на етапі 1, який вимагав 27-кратного розведення (5 мкл запасу гідролізату + 135 мкл буфера) з розділу 6.3.1, нмоль у 10 мкл розведеного зразка розраховується наступним чином:
3,3 нмоль значно нижче межі 140 нмоль, тому зразок є прийнятним.
Метод ВЕРХ AccQ • Tag, комерціалізований корпорацією Waters Corporation у 1992 році, використовує той самий етап дериватизації перед колонкою, що і метод AccQ • Tag Ultra, який був запроваджений у 2006 році. AQC), дериватизує первинні та вторинні аміни в простій одноетапній реакції, отримуючи високостійкі флуоресцентні аддукти. Ми пропонуємо метод AccQ • Tag як системний пакет, який включає розфасовані реагенти та велику документацію. Пакет AccQ • Tag містить хімію, необхідну для проведення до 250 аналізів амінокислот білка та пептидного гідролізату.
Набір AccQ • Tag Derivatization містить п’ять наборів дериватизуючих реагентів. Кожен набір реагентів включає по одному флакону, кожен із наступного:
- AccQ • Фтор-боратний буфер - доданий до зразків для забезпечення оптимального рН для дериватизації.
- AccQ • Порошок фторреагенту - 6-амінохіноліл-N-гідроксисукцінімідилкарбамат. (AQC) дериватизуючий реагент (доставляється сухим для максимальної стабільності).
- AccQ • Розчинник фтор-реагенту - ацетонітрил, використовується для відновлення реагенту для дериватизації.
Малюнок 11. Репрезентативні хроматограми амінокислотного аналізу на основі ВЕРХ з використанням методу Waters AccQ • Tag.
Розчин для аналізу амінокислот Waters UPLC цілісно розроблений для аналізу амінокислот під ключ. Похідні дериватизовані амінокислоти розчиняють у системі Waters ACQUITY ™ UPLC із використанням включеного AccQ • Tag Ultra, колони UPLC з оберненою фазою, елюентів та методів. Міцна хімія дериватизації, стабільні хроматографічні базові лінії та чудова роздільна здатність амінокислот допомагають забезпечити точні, точні та послідовні кількісні результати.
Рішення для аналізу амінокислот UPLC включає:
- Waters AccQ • Засоби хімічної обробки Tag Ultra, включаючи колонку, реагенти та елюенти - все тестування QC із застосуванням амінокислотного аналізу
- Empower 2 Програмне забезпечення, попередньо налаштовані проекти, методи та формати звітів
- Повна документація щодо підтримки системи та рівня додатків
Система Waters ACQUITY UPLC підтримує три різні оптичні детектори: регульований УФ, PDA та флуоресцентний детектор.
Рисунок 12. Розчин для аналізу амінокислот UPLC UPSC.
6.5.1 Точний аналіз амінокислот на основі різних матриць зразків
Рішення для аналізу амінокислот UPLC включає два повні методи, що використовують однакові прилади та хімію. Перший підходить для амінокислот, отриманих з білкових гідролізатів. Другий придатний для більшої кількості вільних амінокислот, що містяться в зразках процесу, таких як культура клітин або ферментаційні бульйони. Методи відрізняються розведенням AccQ • Tag Ultra Eluent A та температурою розділювальної колони. Немає коригувань рН або модифікацій складу ні для елюентів А, ні для елюентів B.
Рисунок 13. Репрезентативні хроматограми UPLC AccQ • Tag Solutions. (А) Поділ стандартних амінокислот за допомогою методу гідролізату розчину для аналізу амінокислот UPLC. (B) Поділ більшого набору стандартних амінокислот за допомогою розчину для аналізу амінокислот UPLC Метод клітинної культури. Ніяких модифікацій рухомої фази або композиції не потрібно.
6.5.2 Амінокислотний аналіз гідролізованих білків
Амінокислотний аналіз білків використовується як як частина структурного визначення, так і як міра загальної кількості білка у зразку. Зразок гідролізують перед аналізом. Для структурних аналізів спостережувані молярні співвідношення амінокислот порівнюють із значеннями, очікуваними від послідовності.
Що стосується кількості білка, ваги амінокислот підсумовуються. Цей показник концентрації білка використовується для розрахунку коефіцієнтів вимирання, коли склад зразка перешкоджає загальним аналізам білка. Для оцінки поживності продуктів харчування та кормів використовуються як вагові відсотки кожної амінокислоти, так і загальна маса білка. Рішення для аналізу амінокислот Waters UPLC забезпечує надійний, рутинний аналіз усіх цих програм.
Малюнок 14. Амінокислотний аналіз чистого білкового гідролізу.
Рисунок 15. Амінокислотний аналіз гідролізованого раціону птиці.
- Вимоги до амінокислот для утримання у дорослому півні Журнал харчування Оксфорд
- Зміни жовчних кислот та мікробіоти кишечника при ожирінні, спричиненому дієтою з високим вмістом жиру у моделі щурів
- Квітковий миючий засіб очищує брудні води Росії - Business Line
- 3 низькокалорійні домашні ароматизовані води - Veg Girl RD
- Beverly International Mass Maker Ultra Chocolate - 3 фунти нового розміру