Журнал біомедичних наук
1 Інститут Materia Medica, Китайська академія медичних наук та Пекінський медичний коледж, Пекін, КНР
2 Жіноча та дитяча лікарня, Університет Циндао, Циндао, КНР
* Автор-кореспондент: Чанг Лю
Інститут Materia Medica, китайський
Академія медичних наук і Пекін
Медичний коледж Юніон, Пекін, КНР.
Тел .: 86-18553263607
Електронна пошта: [електронна пошта захищена]
Дата отримання: 03 травня 2017 р .; Дата прийняття: 16 травня 2017 р .; Дата публікації: 23 травня 2017 р
Цитування: Liu C, Jin H, Yu B, et al. 90-денне дослідження повторної дозової пероральної токсичності йонкенафілу гідрохлориду у собак Бігль. J Biomedical Sci. 2017, 6: 3. doi: 10.4172/2254-609X.100067
Анотація
Йонкенафіл гідрохлорид, новий синтетичний інгібітор фосфодіестерази типу 5, є перспективним препаратом для лікування еректильної дисфункції. Токсичність повторних доз йонкенафілу гідрохлориду оцінювали у собак біглів самців та самок. Двадцять чотири собаки були випадковим чином розподілені до чотирьох груп і вводили йонкенафіл гідрохлорид перорально у дозах 0, 7, 30 або 120 мг/кг/день протягом 90 днів з наступним 28-денним періодом відновлення. Протягом досліджуваного періоду досліджували клінічні ознаки, смертність, масу тіла, споживання їжі, офтальмоскопію, електрокардіографію, гематологію, біохімію сироватки крові, аналіз сечі, вагу органів, загальні дані та гістопатологію. У клінічних спостереженнях не спостерігалось ніяких аномальних змін, за винятком того, що у групі 120 мг/кг/день спостерігалась непереносимість шлунково-кишкового тракту. Лабораторні та гістогістологічні дослідження виявили токсичність гідрохлориду йонкенафілу для різних органів, включаючи щитовидну залозу, печінку, простату, матку та молочну залозу; наприкінці відновного періоду ця шкода була вирішена. Рівень йонкенафілу гідрохлориду, який не призвів до помітних побічних ефектів у собак бігль, становив 7 мг/кг/добу.
Ключові слова
Йонкенафіл гідрохлорид; Імпотенція; Токсичність; Клінічні ознаки
Вступ
Згідно з визначенням Конференції з питань імпотенції з розробки консенсусу Національного інституту охорони здоров’я, еректильна дисфункція (ЕД), яка вплине на життя приблизно 300 мільйонів чоловіків у всьому світі до 2025 року, - це нездатність досягти або підтримати ерекцію, достатню для задовільного сексуальна ефективність [1,2]. В даний час фармакотерапія є основним методом лікування ЕД. Відповідно до рекомендацій Американської урологічної асоціації (АУА) щодо ЕД, першою лінією лікування ЕД повинні бути інгібітори фосфодіестерази 5 типу (PDE5), до яких належать силденафіл, тадалафіл та варденафіл [3]. Як правило, лікування ЕД інгібіторами PDE5 добре переноситься, хоча повідомлялося про деякі побічні ефекти, такі як головний біль, гіперемія, диспепсія, закладеність носа та незвичні порушення зору [4,5]. Інгібітори PDE5 за своєю структурою подібні до cGMP і конкурують з cGMP в каталітичній ділянці PDE5. Інгібування PDE5 у кавернозному тілі людини збільшує внутрішньоклітинний рівень цГМФ у клітинах гладкої мускулатури трабекулярних тканин для досягнення розслаблення та збільшення припливу крові до статевого члена [6-9]. Недавні дослідження показали, що інгібітори PDE5 мають надзвичайний терапевтичний ефект при багатьох інших захворюваннях, таких як доброякісна гіперплазія передміхурової залози, легенева гіпертензія та хвороба Альцгеймера [10-12].
З широким успіхом та прийняттям цих агентів був викликаний великий інтерес до потенціалу інгібіторів PDE5. Кілька нових інгібіторів PDE5, таких як аванафіл, уденафіл, SLx-2101 та міроденафіл, є кандидатами на вихід на ринок у найближчі роки [13]. Йонкенафіл гідрохлорид, новий синтетичний інгібітор PDE5 та аналог силденафілу, є перспективним препаратом для лікування ЕД. Йонкенафіл (IC50 = 2,0 нМ) фармакологічно активніший за силденафіл (IC50 = 4,5 нМ) і має меншу кількість побічних ефектів з боку шлунково-кишкового тракту [14]. Попередні дослідження також продемонстрували, що йонкенафіл може ефективно зменшити інфаркт головного мозку, неврологічний дефіцит, набряки та пошкодження нейронів в зоні інфаркту [14,15], а також пригнічує активацію мікроглії для сприяння виживанню нейронів [16,17]. Йонкенафіл був переданий до Китайського управління харчових препаратів (CFDA) на затвердження як новий препарат, і зараз він проходить клінічні випробування в Китаї [18].
Однак інформація щодо токсичності йонкенафілу дуже обмежена. Розуміння профілю безпеки йонкенафілу є обов’язковим для повного передбачення його терапевтичного потенціалу. Це дослідження було розроблене для оцінки токсичності повторних доз йонкенафілу гідрохлориду у собак бігль з метою отримання інформації про безпеку йонкенафілу гідрохлориду. Дослідження проводилось відповідно до "Керівних принципів довготривалих тестів на токсичність хімічних речовин", наданих Китайською адміністрацією з контролю за продуктами та ліками (CFDA) згідно з Правилами належної лабораторної практики. Це дослідження було проведено відповідно до принципів та процедур, викладених у Національному керівництві інститутів охорони здоров’я щодо догляду та використання лабораторних тварин. Цей протокол був схвалений Інститутом комітету з питань догляду за тваринами та добробуту Materia Medica, CAMS & PUMC.
Матеріали і методи
Тестова стаття
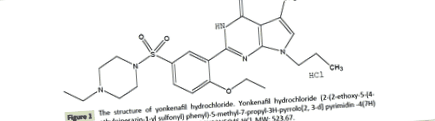
Йонкенафіл гідрохлорид (Фігура 1) (чистота 99,40%) - це водорозчинний порошок жовтого кольору без запаху. Капсули (300-500 мг, 200-300 мг, 40-50 мг йонкенафілу гідрохлориду/капсули) були отримані від Tianjin Tasly Company Ltd. (Тяньцзінь, Китай) і використовувались для перорального прийому в цьому дослідженні. Кількість капсул для кожної собаки розраховували щотижня, виходячи з недавньої маси тіла.
Фігура 1: Структура йонкенафілу гідрохлориду. Йонкенафіл гідрохлорид (2- (2-етокси-5- (4- етилпіперазин-1-ілсульфоніл) феніл) -5-метил-7-пропіл-3Н-пірололо [2,3-г] піримідин -4 (7Н) - один- гідрохлорид). Формула: C24H33N5O4S · HCl, МВт: 523.67.
Тварини та тваринництво
Тридцять дві здорових собаки біглів чоловічої та жіночої статі вагою 6-8 кг і віком 6-12 місяців були отримані з Інституту лабораторних наук про тварин, Медичного коледжу Пекінського союзу та Китайської академії медичних наук (Пекін, Китай). Усі собаки були акліматизовані в експериментальних установках протягом 4 тижнів до початку експерименту. Тварин поселяли індивідуально в клітинах і утримували в кімнаті для тварин, яка контролювалась навколишнім середовищем. У приміщенні для тварин спостерігали і підтримували протягом 12 годин циклу світло-темрява, який контролювався за допомогою автоматичного таймера з температурою 23 ± 5 ° C і відносною вологістю від 40% до 60%. Частота вентиляції становила 15 разів h-1 протягом усього дослідження. Собакам був наданий вільний доступ до сертифікованої розширеної дієти (Лабораторний центр науки про тварин, Академія військово-медичних наук, Пекін, Китай). Муніципальна вода, яка переробляється через мембрану зворотного осмосу, подавалася собакам ad libitum.
Дизайн дослідження та вибір дози
Чоловічих і жіночих собак (n = 4/стать/доза) розподіляли випадковим чином у чотири групи лікування (0, 7, 30 та 120 мг/кг/добу йонкенафілу гідрохлориду). По закінченню періоду лікування на 90-й день двох тварин на стать за групу забивали під пентобарбітальною анестезією, а решту двох тварин за статтю досліджували після 28-денного періоду відновлення.
Вибір рівнів дозування в поточному дослідженні базувався на результатах дослідження гострої токсичності йонкенафілу гідрохлориду на мишах та фармакодинамічних даних щурів. У гострому дослідженні LD50 становив 2000 мг/кг/добу, а 95% довірчий інтервал становив від 1610 до 2438 мг/кг/добу. У фармакодинамічному дослідженні мінімальна ефективна доза становила 6 мг/кг/день, а максимальна ефективна доза - 24 мг/кг/день. Оптимальна доза становила 12 мг/кг/добу. У цьому дослідженні 120 мг/кг/добу було вказано як високу дозу, яка в 33,3 рази перевищувала оптимальну ефективну дозу. Більш низькі дози 30 мг/кг/день та 7 мг/кг/день були обрані як рівні середньої та низької доз відповідно.
Клінічне спостереження
Смертність та клінічні спостереження реєстрували щодня. Вагу тіла та температуру всіх тварин вимірювали двічі протягом карантинного періоду та один раз на тиждень під час прийому та відновлення. Споживання їжі вимірювали двічі протягом карантинного періоду та з тижневими інтервалами під час лікування та реконвалесценції. Кількість їжі (приблизно 300 г) реєстрували перед подачею в кожну клітку, а залишок їжі вимірювали на наступний день, щоб визначити відмінності, які розглядались як щоденне споживання їжі (г на 100 г ваги тіла).
Офтальмоскопічні обстеження проводили кожній собаці перед початком лікування (день -14, день -7, тобто 14 і 7 днів до початку лікування відповідно), протягом періоду лікування (день 45), після останньої дози (день 90 ) та після одужання (день 118) за допомогою бінокулярного непрямого офтальмоскопа (Topcon, Японія). Зони спостереження включали рогівку, кон’юнктиву, склеру, райдужку, кришталик та очне дно. Електрокардіограми проводили 14-го, 7-го, 45-го, 90-го та 118-го днів для вимірювання частоти серцевих скорочень, інтервалу P-R, інтервалу QRS та інтервалу QT.
Параметри лабораторних випробувань
Зразки крові відбирали у всіх тварин на 14-й, 7-й, 45-й, 90-й і 118. день. Зразки сечі відбирали у всіх тварин на 90-й і 118. день. отриманий зразок крові/сечі. Зразки крові брали з вени передньої кінцівки в евакуйовані пробірки для збору крові. Під наркозом сечу збирали із сечового міхура на зразок тест-паперу через катетер. ЕДТА та цитрат натрію використовувались як антикоагулянти для дослідження згортання крові.
Гематологія та згортання крові
Гематологічні параметри оцінювали за допомогою автоматизованого гематологічного аналізатора MEK-6318K (Nihon-Kodhen Co., Токіо, Японія) щодо кількості еритроцитів (RBC), гемоглобіну (Hb), гематокриту (HCT), середнього корпускулярного об'єму (MCV), середнього корпускулярного гемоглобін (MCH), середня концентрація корпускулярного гемоглобіну (MCHC), коефіцієнт варіації ширини розподілу еритроцитів (RDW-CV), кількість тромбоцитів (PL), середній об'єм тромбоцитів (MPV), ширина розподілу тромбоцитів (PDW), тромбоцитарний крит (PCT), кількість лейкоцитів (WBC) та диференціальна кількість клітин (DC). Мазки крові фарбували блискучо-крезилово-синім кольором Райта-Гімзи (Heath and Daland, 1931), а кількість світлових мікроскопів проводили підрахунок ретикулоцитів (Reti).
Параметри коагуляції, включаючи тромбіновий час (TT), протромбіновий час (PT), активований частковий тромбопластиновий час (APTT) та fi бріноген (Fbg), оцінювали за допомогою набору DIAGNOSTICA STAGO STA-4 Coagmaster (Junior Instruments Co., Gennevilliers, Франція).
Біохімія сироватки крові
Хімічні параметри крові визначали за допомогою автоаналізатора Vitalab (Vital Scientic, Дірен, Нідерланди) та автоелектролітного аналізатора AVL-9181 (AVL Scientic, Co., Розуелл, Джорджія, США). Виміряними параметрами були аспартатамінотрансфераза (AST), аланінамінотрансфераза (ALT), лужна фосфатаза (ALP), глюкоза (GLU), азот сечовини крові (BUN), сечова кислота (UA), лактатдегідрогеназа (LDH), загальний білок (TP ), альбумін (ALB), загальний білірубін (T-BIL), загальний холестерин (T-CHO), тригліцериди (TG), креатинін (CRE), креатинкіназа (CK), співвідношення альбумін-глобулін (A/G) та рівні кальцію (Ca), натрію (Na), калію (K) та хлориду (Cl) у сироватці крові.
Аналіз сечі
Аналіз сечі проводили за допомогою смужок Multistrix ® (Bayer Corp., Bridgend, Південний Уельс, Великобританія) для параметрів, включаючи глюкозу (GLU), білірубін (BIL), кетони (KET), специфічну вагу (SG), приховану кров (BLO), рН, білок (PRO), уробіліноген (URO), нітрити (NIT), лейкоцити (LEU) та сечовий осад.
Розтин та гістологічне дослідження
В кінці періоду лікування 2 собаки/стать/група були померлі під ефірною анестезією, а решта дві собаки/стать/група були померлі в кінці періоду відновлення. Був проведений ретельний розтин, а також вирізані та зважені такі органи: мозок, легені, серце, печінка, селезінка, тимус, нирки, наднирники, простата, яєчка, епідидиміт, матка та яєчники. Розраховували та реєстрували відносну масу (маса на 100 г маси тіла) кожного органу. Вищезазначені органи та щитовидна залоза, паращитовидні залози, слинні залози, жовчний міхур, підшлункова залоза, грудина та кістковий мозок, спинний мозок, гіпофіз, стравохід, шлунок, кишечник (дванадцятипала кишка, тонка кишка, товста кишка та товста кишка), лімфатичні вузли (брижові), сечовий міхур, молочну залозу, трахею, сідничний нерв та зоровий нерв фіксували у 10% розчині формалізованого буферу. Ці зразки регулярно обробляли, вкладали у парафін, розділяли на 5 мкм і фарбували гематоксилін-еозином для гістопатологічного дослідження.
Токсикокінетика
Зразки крові отримували на 1-й день (0,5, 1, 2, 3, 4, 5, 6, 7, 8, 24 год після дозування), 45-й день (0,5, 5, 24 год після введення), 90-й день (0,5, 5, 24, 48, 72, 96 год після дозування) та 118-й день для визначення рівня гідрохлориду йонкенафілу у плазмі крові. Кожного разу з вени передніх ніг собак брали приблизно 2,0 мл крові; зразки збирали в пробірки, що містять гепарин. Зразки крові негайно центрифугували, а зразки плазми зберігали в морозильній камері до -20 ° C до аналізу. Після розморожування при кімнатній температурі зразки плазми вихрово перемішували і аликвоту (100 мкл) змішували зі 100 мкл I.S. (внутрішній стандарт) (діазепам 250 нг/мл) і 100 мкл метанолу: вода (50:50, об/об) і 50 мкл NaOH (1 М) у 10 мл пробірці з закупореною кришкою. Суміш перемішували на вортексі протягом 10 с і екстрагували 3,0 мл діетилового ефіру: дихлорметан, 60:40, об/об).
Після струшування протягом 10 хв і центрифугування при 3500 × g протягом 5 хв верхню органічну фазу обережно переносили в іншу пробірку і випаровували при 40 ° С під слабким потоком азоту. Залишок відновлювали в 200 мкл рухомої фази і 20 мкл вводили в систему LC-MS/MS. Визначення ТЗ проводилося в Коледжі наук про життя Університету Цзілінь (Чанчунь, Китай).
Статистичний аналіз
Експериментальні групи порівнювали з контрольною групою з точки зору маси тіла, споживання їжі, гематологічних показників (крім диференціальної кількості лейкоцитів та кількості ретикулоцитів), показників хімічного складу крові та ваги органів. Якщо дані були однорідними за тестом Бартлетта, використовували односторонній дисперсійний аналіз (ANOVA). Якщо дані не були однорідними (а також для диференціальної кількості лейкоцитів та кількості ретикулоцитів), застосовували тест Крускала-Уолліса. Параметри, визнані важливими при односторонньому дисперсійному аналізі (ANOVA), оцінювали за допомогою тесту Даннета. Дані про відсотки та співвідношення результатів аналізу сечі оцінювали за допомогою тестів хі-квадрат. Рівні значущості для парних порівнянь повідомлялись на рівні p 0,798, p
- Дослідження 100 немовлят та маленьких дітей з алергією на коров’яче молоко SpringerLink
- Дослідження використання природного сорбенту для відновлення катіонів заліза з водних розчинів
- Дослідження закономірностей використання еторикоксибу у Франції (MK-0663-148) - Повний текст
- Асоціація між ІМТ, кров'яним тиском та дослідженням віку серед племінних чоловіків Тангхул Нага
- Абдомінопластика, всмоктувальна ліпектомія та репарація вентральної грижі - Бюлетені медичної клінічної політики